题目内容
10.下列电离方程式错误的是( )| A. | (NH4)2SO4溶于水:(NH4)2SO4═2NH4++SO42- | |
| B. | H3PO4溶于水:H3PO4?3H++PO43- | |
| C. | HF溶于水:HF?H++F- | |
| D. | NaHS溶于水:NaHS═Na++HS- |
分析 A.硫酸铵为强电解质,在溶液中完全电离出铵根离子和硫酸根离子;
B.磷酸为弱酸,电离方程式分步书写,主要写出第一步的电离即可;
C.氢氟酸为弱酸,在溶液中部分电离,电离方程式用可逆号;
D.硫氢化钠在溶液中完全电离出钠离子和硫氢根离子.
解答 解:A.(NH4)2SO4溶于水完全电离出铵根离子和硫酸根离子,其电离方程式为:(NH4)2SO4═2NH4++SO42-,故A正确;
B.磷酸为弱酸,在溶液中部分电离,电离方程式分步书写,主要以第一步为主,H3PO4正确的电离方程式为:H3PO4?H++H2PO4-,故B错误;
C.HF溶于水部分电离出氟离子和氢离子,电离方程式为:HF?H++F-,故C正确;
D.NaHS溶于水完全电离出钠离子和硫氢根离子,电离方程式为:NaHS═Na++HS-,故D正确;
故选B.
点评 本题考查了电离方程式的书写方法判断,题目难度不大,正确判断强弱电解质为解答关键,注意掌握电离方程式的书写原则,试题培养了学生的规范答题能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列装置或操作不能达到目的是( )
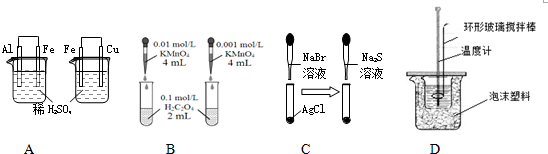

| A. | 依据左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡,判断活动性:Al>Fe>Cu | |
| B. | 依据褪色快慢比较浓度对反应速率的影响 | |
| C. | 依据白色固体先变为淡黄色,后变为黑色(Ag2S),判断溶解性:AgCl>AgBr>Ag2S | |
| D. | 用该装置测定中和热 |
5. 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列说法正确的是( )
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列说法正确的是( )
 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列说法正确的是( )
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列说法正确的是( )| A. | 反应开始到t2时,反应达到平衡状态 | |
| B. | 反应开始到t1(t1=1s),N的物质的量浓度变化了2mol/L | |
| C. | 反应开始到t2(t2=2s),用M表示反应速率为0.5mol/(L.s) | |
| D. | 反应的化学方程式为:N(g)?2M(g) |
15.下列有关第ⅦA族元素说法中不正确的是( )
| A. | 原子最外层电子数都是7 | B. | 熔、沸点:F2<Cl2<Br2<I2 | ||
| C. | 从F2到I2,颜色逐渐加深 | D. | 从F2到I2,氧化性逐渐增强 |
2.把a、b、c、d四块金属片浸入稀硫酸,分别用导线两两连接,可以组成原电池.a、b相连时,a为负极;c、d相连时,电流方向为d→c;a、c相连时,c极产生大量气泡;b、d相连时,d极上发生氧化反应.这四种金属的活动性由强到弱的顺序是( )
| A. | a b c d | B. | a c d b | C. | c a b d | D. | b d c a |
16.下列物质不溶于水的是( )
| A. | NH4HC2O4 | B. | MnSO4 | C. | MgSO3 | D. | ZnCl2 |