题目内容
18.将7.8g 锌加入到100mL 1mol/L硫酸中,完全反应后,试计算:(1)锌和硫酸哪种反应物有剩余?剩余物质的质量是多少?在标准状况下生成氢气的体积是多少升?
(2)将反应后所得溶液加水稀释成250mL,其物质的量浓度是多少?
分析 (1)根据反应方程式Zn+H2SO4═ZnSO4+H2↑ 分析锌和硫酸的量的相对大小,根据计算锌的物质的量为0.12mol,硫酸的物质的量为0.1mol,可知锌过量,再根据反应方程式可计算出反应消耗的锌的质量进而可以推出剩余锌的质量以及生成氢气的体积;
(2)根据反应生成产物的物质的量以及溶液的体积可以推算出溶质的物质的量浓度.
解答 解:(1)设跟硫酸反应的锌的质量为x,反应后生成氢气的体积为y
Zn+H2SO4═ZnSO4+H2↑
65g 1mol 22.4L
x 0.1L×1mol/L y
$x=\frac{0.1mol×65g}{1mol}=6.5g$(1分)
锌有剩余;
剩余锌的质量为:7.8g-6.5g=1.3g
H2的体积$y=\frac{22.4L×0.1mol}{1mol}=2.24L$(1分)
(2)溶液的物质的量浓度为:$\frac{0.1mol}{0.25L}=0.4mol/L$(1分)
答:(1)锌有剩余;锌剩余的质量为1.3g;在标准状况下生成氢气的体积是2.24L;
(2)溶液中溶质的物质的量浓度为0.4mol/L.
点评 本题考查根据方程式的有关计算,比较基础,注意基础知识的理解掌握.

练习册系列答案
相关题目
9.下列有关实验现象的描述中,正确的是( )
| A. | 金属钠在氯气中燃烧,有白雾生成 | |
| B. | 铜在氯气中燃烧,生成蓝色的氯化铜颗粒 | |
| C. | 红热的铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体 | |
| D. | 氢气在氯气中燃烧产生大量的白烟 |
6.用下列实验装置或操作进行的实验能达到实验目的是( )
| A. | 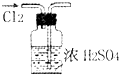 干燥Cl2 | B. | 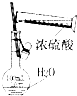 配制100ml 0.1mol•L-1硫酸溶液 | ||
| C. | 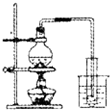 制取少量蒸馏水 | D. | 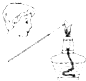 检验钾元素的存在 |
3.常温下,0.2mol•L-1的盐酸30mL分别加适量水与下列Na2CO3溶液混合后,总体积均为100mL,其中最初产生CO2的速率最快的是( )
| A. | 20mL0.3 mol•L-1Na2CO3 | B. | 10mL0.4 mol•L-1Na2CO3 | ||
| C. | 25mL0.4 mol•L-1Na2CO3 | D. | 15mL0.5 mol•L-1Na2CO3 |
10.下列电离方程式错误的是( )
| A. | (NH4)2SO4溶于水:(NH4)2SO4═2NH4++SO42- | |
| B. | H3PO4溶于水:H3PO4?3H++PO43- | |
| C. | HF溶于水:HF?H++F- | |
| D. | NaHS溶于水:NaHS═Na++HS- |
7.甲醇燃料电池(DMFC)可用于笔记本电脑、汽车等,它一极通入甲醇;电解质是质子交换膜,它能传导氢离子.电池工作时,甲醇被氧化为二氧化碳和水.下列叙述中,不正确的是( )
| A. | 负极的反应式为:CH3OH+H2O-6e-═CO2↑+6H+ | |
| B. | 氧气在电极上的反应是O2+4H++4e-═2H2O | |
| C. | 通入甲醇的一极为负极,通入氧气的一极为正极 | |
| D. | 燃料电池的能量转化率能达到100% |
