题目内容
6.按要求填写下列空格(1)同温同压下,有0.3molO2与0.2molO3,它们的质量之比为1:1,它们所含的原子数之比为1:1,它们的体积之比为3:2,它们的密度之比为2:3.
(2)由${\;}_{1}^{1}$H和${\;}_{8}^{18}$O构成的水摩尔质量为20g•mol-1,10g该水分子的物质的量为0.5mol,含中子5mol.
(3)实验室需要0.1mol•L-1 NaOH溶液480mL.根据溶液的配制情况回答下列问题:根据计算用托盘天平称取NaOH的质量为2.0g.在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度大于0.1mol•L-1(填“大于”“等于”或“小于”,下同).若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度小于0.1mol•L-1.
分析 (1)根据n=$\frac{V}{{V}_{m}}$=$\frac{m}{M}$=$\frac{N}{NA}$结合物质的构成计算相关物理量;
(2)${\;}_{1}^{1}$H和${\;}_{8}^{18}$O构成的水摩尔质量为(1×2+18)g/mol,然后根据n=$\frac{m}{M}$,一个水分子中含有10个中子;
(3)根据n=cV和m=nM来计算,根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 解:(1)m(O2)=0.3mol×32g/mol=9.6g,m(O3)=0.2mol×48g/mol=9.6g,它们的质量之比为1:1;
由n=$\frac{N}{NA}$可知结合它们所含的原子数之比为0.3mol×2:0.2mol×3=1:1;
由n=n=$\frac{V}{{V}_{m}}$可知,它们的体积之比为0.3:0.2=3:2;
由ρ=$\frac{M}{Vm}$可知,它们的密度之比等于相对分子质量之比,为32:48=2:3,
故答案为:1:1;1:1;3:2;2:3;
(2)由${\;}_{1}^{1}$H和${\;}_{8}^{18}$O构成的水摩尔质量为(1×2+18)g/mol,n=$\frac{m}{M}$=$\frac{10g}{20g/mol}$=0.5mol,中子的物质的量为0.5mol×10=5mol,
故答案为:20g/mol;0.5mol;5;
(3)配制0.1mol•L-1 NaOH溶液480ml,由于无480mL容量瓶,故应选用500mL容量瓶,所需的氢氧化钠的物质的量n=cV=0.1mol/L×0.5L=0.05mol,质量m=nM=0.05mol×40g/mol=2.0g;定容时俯视刻度线,会导致溶液体积偏小,则浓度偏大,若NaOH溶液在转移至容量瓶时,洒落了少许,溶质损失,浓度偏小,
故答案为:2.0;大于;小于.
点评 本题考查物质的量的相关计算,误差分析,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用,难度不大.

 阅读快车系列答案
阅读快车系列答案
| A. | 当该卤代烃发生取代反应时,被破坏的键是①和③ | |
| B. | 当该卤代烃发生消去反应时,被破坏的键是①和③ | |
| C. | 当该卤代烃发生水解反应时,被破坏的键② | |
| D. | 当该卤代发生消去反应时,被破坏的键是①和② |
①2CH3OH(I)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
③H2O(g)═H2O(I)△H=-44.0kJ/mol
请写出1mol甲醇不完全燃烧生成1mol一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol.
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图1装置模拟上述过程:

①写出阳极电极反应式Co2+-e-=Co3+;
②除去甲醇的离子反应为:6Co3++CH3OH+H2O═CO2↑+6Co2++6H+.该过程中被氧化的元素是碳,当产生标准状况下2.24LCO2时,共转移电子0.6mol.
(3)测定稀硫酸和稀氢氧化钠中和热的实验装置如图2所示.0.50mol/LNaOH溶液50mL和0.50mol/L硫酸溶液30mL进行实验,实验数据如表所示.
①请写下表中的空白.
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t℃/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值与57.3kJ/mol有偏差,产生偏差的原因可能是acd.
a.实验装置保湿或隔热效果差 b.用量筒量取NaOH溶液的体积时俯视读数
c.用环形铜丝搅拌棒搅拌溶液 d用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
| A. | 该元素原子中共有25个电子 | B. | 该元素原子核外有4个能层 | ||
| C. | 该元素原子最外层共有2个电子 | D. | 该元素原子M电子层共有8个电子 |
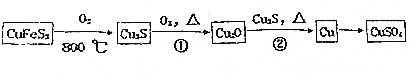
 如图为两套实验装置.
如图为两套实验装置.
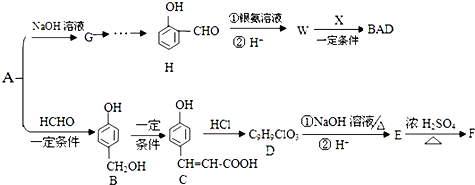
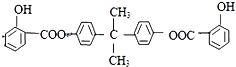
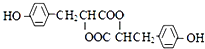
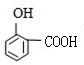 .
.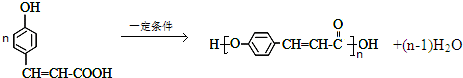 .
. .
.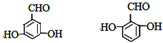 .
.