题目内容
16.某原子的电子排布式为1s22s22p63s23p63d54s2,下列说法中不正确的是( )| A. | 该元素原子中共有25个电子 | B. | 该元素原子核外有4个能层 | ||
| C. | 该元素原子最外层共有2个电子 | D. | 该元素原子M电子层共有8个电子 |
分析 A、该元素原子中共有25个电子;
B、某原子的电子排布式为1s22s22p63s23p63d54s2,所以该元素原子核外有4个能层;
C、3d54s2可知该元素原子最外层共有2个电子;
D、该元素原子M电子层共有2+6+5=13个电子.
解答 解:A、该元素原子中共有2+8+13+2=25个电子,故A正确;
B、某原子的电子排布式为1s22s22p63s23p63d54s2,所以该元素原子核外有4个能层,故B正确;
C、3d54s2可知该元素原子最外层共有2个电子,故C正确;
D、该元素原子M电子层共有2+6+5=13个电子,而不是8个电子,故D错误;
故选D.
点评 本题考查原子核外电子排布,根据构造原理推断出R的原子核外电子排布,本题难度中等.

练习册系列答案
相关题目
7.将0.2mol KMnO4在一定温度下加热后生成a mol O2;将剩余固体与过量浓盐酸混合加热又生成b mol Cl2,此时锰元素均以Mn2+形式存在.若a+b=m,则m的值可能为( )
| A. | 0.30 | B. | 0.35 | C. | 0.40 | D. | 0.50 |
4.有某硫酸和硝酸的混合溶液20mL,其中含有硫酸的浓度为2mol•L-1,含有硝酸的浓度为1mol•L-1,现向其中加入0.96g铜粉,充分反应后(假设只生成NO气体),最多可收集到标准状况下的气体的体积为( )
| A. | 89.6 mL | B. | 112 mL | C. | 168 mL | D. | 224 mL |
11.图是一套检验气体性质的实脸装置.向装里中缓慢通入气体X.若关闭活塞,溉清石灰水变浑浊;若打开活塞,则品红溶液褪色,据此判断气体X 和洗气瓶内的溶液Y可能是( )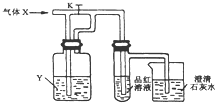

| A. | X是SO2,Y是饱和NaHCO3 溶液 | B. | X是H2S,Y是浓H2SO4 | ||
| C. | X是CO2,Y是Na2SO3 溶液 | D. | X是Cl2,Y是Na2CO3溶液 |
5.已知常温下,在溶液中可发生如下反应:Ce4++Fe2+═Fe3++Ce3+,Sn2++2Fe3+═2Fe2++Sn4+.由此推断Fe2+、Ce3+、Sn2+的还原性由强到弱的顺序是( )
| A. | Sn2+、Fe2+、Ce3+ | B. | Fe2+、Ce3+、Sn2+ | C. | Fe2+、Sn2+、Ce3+ | D. | Ce3+、Fe2+、Sn2+ |
6.下列物质中,既能跟盐酸反应,又能跟NaOH溶液反应的是( )
| A. | NaHCO3 | B. | Fe2O3 | C. | Al2O3 | D. | SiO2 |
 .
.