题目内容
25℃时浓度都是1mol?L-1 的四种正盐溶液:AX、BX、AY、BY,AX的溶液pH=7且溶液中c(X-)=1mol?L-1 ,BX的溶液pH=4,BY溶液pH=6,下列说法正确的是( )
| A、电离平衡常数K(BOH)小于K(HY) |
| B、AY溶液的pH值小于BY的pH |
| C、稀释相同倍数,溶液pH值变化BX小于BY |
| D、将浓度均为1mol?L-1的HX和HY溶液分别稀释10倍后,HX溶液的pH大于HY |
考点:盐类水解的原理
专题:
分析:25℃时浓度都是1mol?L-1 的四种正盐溶液:AX、BX、AY、BY,AX的溶液pH=7且溶液中c(X-)=1mol?L-1 ,则AX是强酸强碱盐,所以AOH是强碱、HX是强酸;
BX的溶液pH=4,HX是强酸,则BX是强酸弱碱盐,BOH是弱碱;
相同浓度时,如果BY是强酸弱碱盐,则BX和BY溶液pH应该相等,实际上相同浓度时BXpH相应BY,则HY是弱电解质,BY是弱酸弱碱盐,且B+水解程度大于Y-;
A.弱电解质的电离平衡常数越大,其离子水解越大越小;
B.AY是弱酸强碱盐、BY是弱酸弱碱盐;
C.同一碱的不同酸的盐溶液,酸性越强,稀释相同倍数,溶液的pH变化越大;
D.稀释相同浓度的不同一元酸溶液,强酸的pH小于弱酸.
BX的溶液pH=4,HX是强酸,则BX是强酸弱碱盐,BOH是弱碱;
相同浓度时,如果BY是强酸弱碱盐,则BX和BY溶液pH应该相等,实际上相同浓度时BXpH相应BY,则HY是弱电解质,BY是弱酸弱碱盐,且B+水解程度大于Y-;
A.弱电解质的电离平衡常数越大,其离子水解越大越小;
B.AY是弱酸强碱盐、BY是弱酸弱碱盐;
C.同一碱的不同酸的盐溶液,酸性越强,稀释相同倍数,溶液的pH变化越大;
D.稀释相同浓度的不同一元酸溶液,强酸的pH小于弱酸.
解答:
解:25℃时浓度都是1mol?L-1 的四种正盐溶液:AX、BX、AY、BY,AX的溶液pH=7且溶液中c(X-)=1mol?L-1 ,则AX是强酸强碱盐,所以AOH是强碱、HX是强酸;
BX的溶液pH=4,HX是强酸,则BX是强酸弱碱盐,BOH是弱碱;
相同浓度时,如果BY是强酸弱碱盐,则BX和BY溶液pH应该相等,实际上相同浓度时BXpH相应BY,则HY是弱电解质,BY是弱酸弱碱盐,且B+水解程度大于Y-;
A.BY是弱酸弱碱盐,且B+水解程度大于Y-,弱离子水解程度越大其相应弱电解质电离程度越小,所以BOH的电离程度小于HY,电离程度越大,其电离平衡常数越大,所以电离平衡常数K(BOH)小于K(HY),故A正确;
B.AY是弱酸强碱盐、BY是弱酸弱碱盐,AY溶液呈碱性、BY溶液呈酸性,所以AY溶液的pH大于BY,故B错误;
C.同一碱的不同酸的盐溶液,酸性越强,稀释相同倍数,溶液的pH变化越大,HX是强酸、HY是弱酸,稀释相同倍数,溶液pH值变化BX大于BY,故C错误;
D.稀释相同浓度的不同一元酸溶液,强酸的pH小于弱酸,HX是强酸、HY是弱酸,所以将浓度均为1mol?L-1的HX和HY溶液分别稀释10倍后,HX溶液的pH小于HY,故D错误;
故选A.
BX的溶液pH=4,HX是强酸,则BX是强酸弱碱盐,BOH是弱碱;
相同浓度时,如果BY是强酸弱碱盐,则BX和BY溶液pH应该相等,实际上相同浓度时BXpH相应BY,则HY是弱电解质,BY是弱酸弱碱盐,且B+水解程度大于Y-;
A.BY是弱酸弱碱盐,且B+水解程度大于Y-,弱离子水解程度越大其相应弱电解质电离程度越小,所以BOH的电离程度小于HY,电离程度越大,其电离平衡常数越大,所以电离平衡常数K(BOH)小于K(HY),故A正确;
B.AY是弱酸强碱盐、BY是弱酸弱碱盐,AY溶液呈碱性、BY溶液呈酸性,所以AY溶液的pH大于BY,故B错误;
C.同一碱的不同酸的盐溶液,酸性越强,稀释相同倍数,溶液的pH变化越大,HX是强酸、HY是弱酸,稀释相同倍数,溶液pH值变化BX大于BY,故C错误;
D.稀释相同浓度的不同一元酸溶液,强酸的pH小于弱酸,HX是强酸、HY是弱酸,所以将浓度均为1mol?L-1的HX和HY溶液分别稀释10倍后,HX溶液的pH小于HY,故D错误;
故选A.
点评:本题考查弱电解质的电离、盐类水解等知识点,为高考高频点,明确电解质HX、HY、AOH、BOH的强弱是解本题关键,易错点是判断HY为弱酸,易错选项是C.

练习册系列答案
相关题目
将固体NH4I置于密闭容器中,在某温度下发生反应:NH4I(固)?NH3(气)+HI(气); 2HI(气)?H2(气)+I2(气).当反应达到平衡时,c(H2)=0.5mol?L-1,c (HI)=4mol?L-1,则氨气的浓度为( )
| A、3.5 mol?L-1 |
| B、4 mol?L-1 |
| C、4.5 mol?L-1 |
| D、5 mol?L-1 |
有机物甲的分子式为C9H18O2,在酸性条件下甲水解为乙和丙两种有机物,且乙和丙分子中含有数目的甲基,在相同的温度和压强下,同质量的乙和丙的蒸气所占体积相同,则甲的可能结构有( )
| A、3种 | B、4种 | C、5种 | D、6种 |
合金比纯金属制成的金属材料的优点是( )
①合金的硬度一般比它的各成分金属的大
②一般地,合金的熔点比它的各成分金属的更低
③改变原料的配比、改变生成合金的条件,得到有不同性能的合金
④合金比纯金属的导电性更强
⑤合金比纯金属的应用范围更广泛.
①合金的硬度一般比它的各成分金属的大
②一般地,合金的熔点比它的各成分金属的更低
③改变原料的配比、改变生成合金的条件,得到有不同性能的合金
④合金比纯金属的导电性更强
⑤合金比纯金属的应用范围更广泛.
| A、①②③⑤ | B、②③④ |
| C、①②④ | D、①②④⑤ |
下列说法正确的是( )
| A、仅用AgNO3溶液便可鉴别亚硝酸钠和食盐 |
| B、重结晶时,溶液冷却速度越慢得到的晶体颗粒越大 |
| C、乙酸与乙醇的混合液可用分液漏斗进行分离 |
| D、可用10mL5mol.L-1的高锰酸钾溶液检验火柴燃烧后生成的气体中是否含有SO2 |
 ):
):

 )与化合物(
)与化合物( )能发生偶联反应生成一种抗抑郁药物,写出该抗抑郁药物的结构简式
)能发生偶联反应生成一种抗抑郁药物,写出该抗抑郁药物的结构简式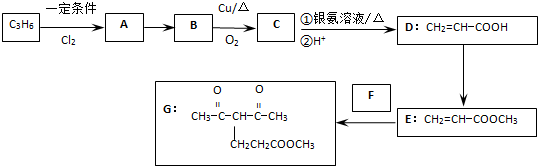

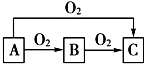 ABC是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去),回答下列问题:
ABC是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去),回答下列问题: