题目内容
16.一定温度下,将3molA气体和1molB气体通过一密闭容器中,发生如下反应:3A(g)+B (g)═xC(g).请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L.
①x=2;
②若反应经2min达到平衡,平衡时C的浓度小于0.8mol/L(填“大于”、“等于”或“小于”);
③平衡混合物中,C的体积分数为22%,则A的转化率是36.1%;
④改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应满足的关系式n(A)+1.5n(C)=3、n(B)+0.5n(C)=1.
(2)若维持容器压强不变
①达到平衡时C的体积分数大于22%,(填“大于”、“等于”或“小于”);
②改变起始物质加入的量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入6molA气体和2molB气体.
分析 (1)一定温度下,将3molA气体和1molB气体通入一密闭容器中,若容器体积固定为 2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则:
3A(g)+B(g)?x C(g)
起始量(mol):3 1 0
变化量(mol):1.2 0.4 0.4x
1min时(mol):1.8 0.6 0.4x
①结合C的浓度计算x;
②后1min内速率小于前1min内反应速率,故后1min内C的浓度变化量小于0.4mol/L;
③令平衡时转化的B为ymol,表示出平衡时各组分的物质的量,再根据C的体积分数为22%列方程计算解答;
④改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,恒温恒容下,反应前后气体体积不相等,按化学计量数转化到左边满足n(A)=3mol、n(B)=1mol;
(2)①由(1)分析可知,随反应进行混合气体物质的量减小,恒温恒容下平衡时压强减小,若维持容器压强不变,等效为在(1)中平衡基础上增大压强,平衡正向移动;
②改变起始物质加入的量,若转化到方程式左边满足n(A):n(B)=3:1,恒温恒压下与原平衡为等效平衡,欲使反应达到平衡时C的物质的量是原平衡的2倍,则开始投入的A、B分别为原平衡起始投入量的2倍.
解答 解:一定温度下,将3molA气体和1molB气体通入一密闭容器中,若容器体积固定为 2L,反应1min时测得剩余1.8mol A,C的浓度为0.4mol/L,则:
3A(g)+B(g)?x C(g)
起始量(mol):3 1 0
变化量(mol):1.2 0.4 0.4x
1min时(mol):1.8 0.6 0.4x
①0.4mol/L×2L=0.4x,则x=2,故答案为:2;
②后1min内速率小于前1min内反应速率,故后1min内C的浓度变化量小于0.4mol/L,故2min达到平衡,平衡时C的浓度小于0.8mol/L,故答案为:小于;
③令平衡时转化的B为ymol,则:
3A(g)+B(g)?2 C(g)
起始量(mol):3 1 0
变化量(mol):3y y 2y
2min时(mol):3-3y 1-y 2y
所以$\frac{2y}{4-2y}$=22%,解得y=$\frac{22}{61}$,故A的转化率为$\frac{3×\frac{22}{61}mol}{3mol}$×100%≈36.1%,
故答案为:36.1%;
④改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,恒温恒容下,反应前后气体体积不相等,按化学计量数转化到左边满足n(A)=3mol、n(B)=1mol,则:n(A)+1.5n(C)=3、n(B)+0.5n(C)=1,
故答案为:n(A)+1.5n(C)=3、n(B)+0.5n(C)=1;
(2)①由(1)分析可知,随反应进行混合气体物质的量减小,恒温恒容下平衡时压强减小,若维持容器压强不变,等效为在(1)中平衡基础上增大压强,平衡正向移动,达到平衡时C的体积分数大于22%,
故答案为:大于;
②改变起始物质加入的量,若转化到方程式左边满足n(A):n(B)=3:1,恒温恒压下与原平衡为等效平衡,欲使反应达到平衡时C的物质的量是原平衡的2倍,则开始投入的A、B分别为原平衡起始投入量的2倍,则应加入6molA气体和2molB气体,
故答案为:6;2.
点评 本题考查化学平衡计算与影响因素、等效平衡等,难度中等,(1)中②注意根据反应速率分析前、后1min内C的浓度变化量,理解等效平衡规律:1、恒温恒容,反应前后气体体积不等,按化学计量数转化到一边,对应物质满足等量;反应前后气体体积相等,按化学计量数转化到一边,对应物质满足等比,2:恒温恒压,按化学计量数转化到一边,对应物质满足等比.

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案| A. | 混合溶液中由水电离出的c(OH-)═10-8 mol•L-1 | |
| B. | c(Na+)═c(X-)+c(HX)=0.1mol•L-1 | |
| C. | c(Na+)-c(X-)═9.9×10-7mol•L-1 | |
| D. | c(OH-)-c(HX)═c(H+)=1×10-8mol•L-1 |
| A. | Mg2+、Cl-、Na+、NO3- | B. | K+、Na+、NO3-、HCO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Na+、Cl-、AlO2-、SO42- |
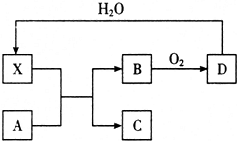 已知X为一种常见酸的浓溶液,能使蔗糖变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物已略去,下列有关说法正确的是( )
已知X为一种常见酸的浓溶液,能使蔗糖变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物已略去,下列有关说法正确的是( )| A. | X能使蔗糖变黑主要体现了 X的强氧化性 | |
| B. | 若A为铁,则足量A与X在室温下即可完全反应 | |
| C. | 若A为碳单质,则将C通入少量澄清石灰水中,最终一定有白色沉淀产生 | |
| D. | 工业上,B转化为D的反应需使用催化剂 |
| A. | 2Na2O2+2H2O═4NaOH+O2↑ | |
| B. | 2Na2O2+2CO2═2NaCO3+O2 | |
| C. | Na2O2+H2SO4(稀)═Na2SO4+H2O2 | |
| D. | Fe2O3+3Na2O2(熔融)═2Na2FeO4十Na2O |
| A. | 化学是在原子、分子水平上研究物质的组成、结构、性质、制备等的自然科学 | |
| B. | 化学是一门具有创造性的科学,可以利用化学知识创造出自然界中不存在的物质 | |
| C. | 化学的发展经过了从宏观到微观,从感性到理性的逐步深化的过程 | |
| D. | 随着化学的发展,人们最终会实现通过化学变化使水变油的梦想 |
I.已知:2CO(g)+O2(g)═2CO2(g),△H=-566kJ•mol-1
2Fe(s)+$\frac{3}{2}$O2(g)═Fe2O3(s),△H=-825.5kJ•mol-1
反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g),△H=-23.5 kJ•mol-1.
Ⅱ.反应 $\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
(1)CO的平衡转化率=60%.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是d.
a.提高反应温度 b.增大反应体系的压强 c.选取合适的催化剂 d.及时吸收或移出部分CO2 e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题:
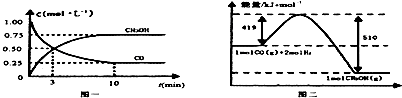
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=0.15mol/(L•min).
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如表:
则下列关系正确的是ADE.
| 容器 | 反应物投入的量 | 反应物的 转化率 | CH3OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ热量 |
E.该反应若生成1mol CH3OH,则放出(Q1+Q2))kJ热量
(3)若在一体积可变的密闭容器中充入l molCO、2molH2和1molCH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向正(填“正”、“逆”)反应方向移动.
(4)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式CH3OH-6e-+8OH-=CO32-+6H2O.
| A. | 1mol固态焦炭与1mol水蒸气反应产生1mol一氧化碳和1mol氢气,吸收131.3 kJ的热量 | |
| B. | 碳与水反应吸收131.3 kJ的热量 | |
| C. | 1mol碳和1mol水反应吸收131.3 kJ的热量 | |
| D. | 固态碳和气态水各1mol反应,放出131.3 kJ的热量 |