题目内容
6.C(s)+H2O(g)?CO(g)+H2(g);△H=+131.3KJ/mol.它表示( )| A. | 1mol固态焦炭与1mol水蒸气反应产生1mol一氧化碳和1mol氢气,吸收131.3 kJ的热量 | |
| B. | 碳与水反应吸收131.3 kJ的热量 | |
| C. | 1mol碳和1mol水反应吸收131.3 kJ的热量 | |
| D. | 固态碳和气态水各1mol反应,放出131.3 kJ的热量 |
分析 C(s)+H2O(g)═CO(g)+H2(g);△H=+131.3KJ/mol表示1mol固体碳与1mol水蒸气完全反应生成1mol一氧化碳气体和1mol氢气,吸收热量131.3KJ,反应热与反应物生成物聚集状态有关,表述时应说明聚集状态,据此解答.
解答 解:A.由热化学方程式可知,1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ,故A正确;
B.在表述热化学方程式时,应表述出物质的状态,故B错误;
C.物质的聚集状态影响到物质所具有的能量,在表述热化学方程式时,应表述出物质的状态,故C错误;
D.该反应为吸热反应,故D错误;
故选:A.
点评 本题考查热化学方程式知识,明确热化学方程式的含义是解题关键,注意物质的聚集状态影响到物质所具有的能量,在表述热化学方程式时,应表述出物质的状态,题目难度不大.

练习册系列答案
相关题目
17.下列离子或分子能够在指定的分散系中大量共存的是( )
| A. | c(H+)=10-13mol/L的溶液中:NO3-、S2O32-、K+、Na+ | |
| B. | 酸性高锰酸钾溶液中:Na+、C2O42-、CH3COO -、NH4+ | |
| C. | 澄清石灰水中:HCO3-、Ba2+、Cl-、NO3- | |
| D. | 空气中:SO2、NO、N2、NH3 |
14.如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法正确的是( )
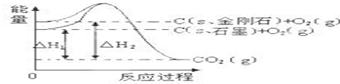

| A. | 1mol石墨的总键能比1mol金刚石的总键能小1.9kJ | |
| B. | 石墨和金刚石的转化是物理变化 | |
| C. | 金刚石的稳定性强于石墨 | |
| D. | C(s、石墨)=C(s、金刚石)△H=+1.9kJ•mol-1 |
1.实验室欲快速制取氢气,应采取的措施是( )
| A. | 用纯锌和稀硫酸反应 | B. | 用含铜等的粗锌和稀硫酸反应 | ||
| C. | 用纯锌和浓硫酸反应 | D. | 用含铜等的粗锌和稀硝酸反应 |
11.工业上一般在恒容密闭容器中可以采用下列反应合成甲醇
CO(g)+2H2(g)?CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同)CD.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(2)如表所列数据是反应在不同温度下的化学平衡常数(K).
①由表中数据判断该反应的△H<0(填“>”、“=”或“<”);
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃.
(3)要提高CO的转化率,可以采取的措施是df.
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
(4)一定条件下,CO与H2在催化剂的作用下生成5molCH3OH的能量变化为454kJ.在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
下列说法正确的是D.
A.2c1>c3 B.a+b<90.8 C.2p2<p3 D. α1+α3<1.
CO(g)+2H2(g)?CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同)CD.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(2)如表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃.
(3)要提高CO的转化率,可以采取的措施是df.
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
(4)一定条件下,CO与H2在催化剂的作用下生成5molCH3OH的能量变化为454kJ.在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 时 数 据 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
A.2c1>c3 B.a+b<90.8 C.2p2<p3 D. α1+α3<1.
18.下列反应的离子方程式错误的是( )
| A. | 向碳酸氢钙溶液中加过量氢氧化钠Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合Ba2++OH-+HCO3-═BaCO3↓+H2O | |
| C. | 氯化铝与过量氨水反应 Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 过量CO2通入氢氧化钡的稀溶液中 CO2+OH-═HCO3- |

 有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品.其构想分成3个步骤:
有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品.其构想分成3个步骤: