题目内容
4.某露置的苛性钠经分析含水:9%(质量分数,下同)、Na2CO3:53%、NaOH:38%.取此样品 10.00g放入100.00mL2.00mol•L-1 的 HCl(aq)中,过量的HCl可用 1.00mol/L NaOH(aq)中和至中性,蒸发中和后的溶液可得固体11.7克.分析 100.00mL 2.00mol/L的 HCl(aq)与碳酸钠、氢氧化钠溶液都反应,因为“中和至中性”,故反应后溶质为NaCl;先求出100.00mL2.00mol/L的氯离子的物质的量,从而得出氯化钠的物质的量,最后根据m=nM计算出氯化钠的质量.
解答 解:100.00mL2.00mol/L的 HCl(aq)中含有HCl的物质的量为:2.00mol/L×0.1L=0.2mol,
碳酸钠、氢氧化钠都与HCl反应生成氯化钠,由于反应后溶液为中性,则反应后溶质为NaCl,
所以蒸干后得到的固体为NaCl,其物质的量为:n(NaCl)=n(HCl)=0.2mol,质量为:58.5g/mol×0.2mol=11.7g,
故答案为:11.7.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.一块质量为0.92g金属钠投入到100ml物质的量浓度0.1mol/l的AlCl3溶液中,反应得到的生成物是( )
| A. | H2、Al(OH)3 | B. | H2、NaAlO2 | C. | H2、NaAlO2、NaCl | D. | H2、Al(OH)3、NaCl |
19.下列物质放在水中,能形成溶液的是( )
| A. | 面粉 | B. | 花生油 | C. | 白糖 | D. | 牛奶 |
14.如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法正确的是( )
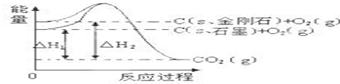

| A. | 1mol石墨的总键能比1mol金刚石的总键能小1.9kJ | |
| B. | 石墨和金刚石的转化是物理变化 | |
| C. | 金刚石的稳定性强于石墨 | |
| D. | C(s、石墨)=C(s、金刚石)△H=+1.9kJ•mol-1 |

 合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用.
合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用.