题目内容
13.下列关于0.1mol/L KNO3溶液的叙述中,正确的是?( )| A. | 1L该溶液中含KNO3101g | |
| B. | 100 mL该溶液中含KNO3 0.01mol | |
| C. | 从1L该溶液中取出500 mL后,剩余溶液的浓度为0.05 mol/L | |
| D. | 1L水中溶解0.1 mol KNO3,即可配得0.1 mol/L KNO3溶液 |
分析 根据n=cV=$\frac{m}{M}$结合溶液为均一、稳定的性质解答该题.
解答 解:A.1 L该溶液中含有KNO3的质量为1L×0.1mol/L×101g/mol=10.1g,故A错误;
B.n(KNO3 )=0.1L×0.1mol/L=0.01mol,故B正确;
C.从1 L该溶液中取出500 mL,所取出的KNO3溶液的浓度仍为 0.1 mol•L-1,故C错误;
D.硝酸钾溶于1L水中,溶液的体积不等于1L,故D错误.
故选:B.
点评 本题考查物质的量的相关计算,侧重于学生的分析能力和计算能力的考查,难度不大,注意把握溶液为均一、稳定的分散系的特点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.近年来我国加强了稀土资源的保护.铈(Ce)是一种稀土元素,它的一种核素中含有58个质子和80个中子,则其表示为( )
| A. | ${\;}_{58}^{80}$Ce | B. | ${\;}_{58}^{138}$Ce | C. | ${\;}_{80}^{58}$Ce | D. | ${\;}_{80}^{138}$Ce |
19.鉴别CII3OCH3和CH3CH2OH可采用化学方法和物理方法,下列方法不能对二者进行鉴别的是( )
| A. | 利用金属钠或金属钾 | B. | 利用质谱法 | ||
| C. | 利用红外光谱 | D. | 利用核磁共振氢谱 |
1.亚硫酰氯(SOCl2)是一种液态化合物,沸点770C.是一种重要的化工产品.加热可发生反应4SOCl2$\frac{\underline{\;200℃左右\;}}{\;}$2SO2+S2Cl2+3Cl2(S2Cl2的沸点为138X:).工业上合成亚硫酰氯方法之一是:
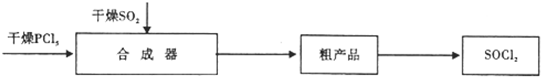
已知:合成器中发生的反应为:PCl5(熔融)+SO2$\frac{\underline{\;一定温度\;}}{\;}$SOCl2+POCl3△H<0 (POCl3 的沸点为105.3℃)
请回答下列问题:
(1)要得到干燥的SO2气体,可将潮湿的SO2通过装有AD的干燥装置(填写字母番号,多选).
A.浓硫酸B.生石灰C.氢氧化钠D.硅胶
(2)工业上从粗产品中,可采用分馏(或蒸馏)的方法(填写操作方法)获得较纯的SOCl2.
(3)合成器的内层,最好选用耐高温、耐氧化、耐腐蚀(工程陶瓷或耐高温陶瓷)材料制成.
(4)已知SOCl2与H2OI发生剧烈反应,有白雾形成并逸出有剌激性气味的气体,请写出该 反应的化学方程式SOCl2+H2O=SO2↑+HCl↑.
(5)SOCl2已Li-SOCl2电池,其电极材料分别为锂和碳,电解液是LiAlCl-SOCl2.电池的总反应可表示为:Li+SOCl2═4LiCl+S+SO2.该电池的负极的电极反应式为Li-e-=Li+
(6)某学习小组用刚吸收过少量SO2的NaOH溶液吸收SOOl2加热分解并冷却至室温后 的气体.吸收一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO${\;}_{4}^{2-}$.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中的CO2的影响).
①提出合理假设.
假设1:只存在SO${\;}_{3}^{2-}$;假设2:既不存在SO${\;}_{3}^{2-}$也不存在ClO-;假设3:只存在ClO-.
②设计实验方案,进行实验.请写出实验步骤以及预期现象和结论.限选实验试剂:3moL.L-1H2SO4溶液、1moL.L-1NaOH溶液、0.1moL.L-1KMnO4溶液、淀粉一KI溶液、紫色石蕊试液.

已知:合成器中发生的反应为:PCl5(熔融)+SO2$\frac{\underline{\;一定温度\;}}{\;}$SOCl2+POCl3△H<0 (POCl3 的沸点为105.3℃)
请回答下列问题:
(1)要得到干燥的SO2气体,可将潮湿的SO2通过装有AD的干燥装置(填写字母番号,多选).
A.浓硫酸B.生石灰C.氢氧化钠D.硅胶
(2)工业上从粗产品中,可采用分馏(或蒸馏)的方法(填写操作方法)获得较纯的SOCl2.
(3)合成器的内层,最好选用耐高温、耐氧化、耐腐蚀(工程陶瓷或耐高温陶瓷)材料制成.
(4)已知SOCl2与H2OI发生剧烈反应,有白雾形成并逸出有剌激性气味的气体,请写出该 反应的化学方程式SOCl2+H2O=SO2↑+HCl↑.
(5)SOCl2已Li-SOCl2电池,其电极材料分别为锂和碳,电解液是LiAlCl-SOCl2.电池的总反应可表示为:Li+SOCl2═4LiCl+S+SO2.该电池的负极的电极反应式为Li-e-=Li+
(6)某学习小组用刚吸收过少量SO2的NaOH溶液吸收SOOl2加热分解并冷却至室温后 的气体.吸收一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO${\;}_{4}^{2-}$.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中的CO2的影响).
①提出合理假设.
假设1:只存在SO${\;}_{3}^{2-}$;假设2:既不存在SO${\;}_{3}^{2-}$也不存在ClO-;假设3:只存在ClO-.
②设计实验方案,进行实验.请写出实验步骤以及预期现象和结论.限选实验试剂:3moL.L-1H2SO4溶液、1moL.L-1NaOH溶液、0.1moL.L-1KMnO4溶液、淀粉一KI溶液、紫色石蕊试液.
| 实验步骤 | 预期现象和结论 |
| 步骤1取少量吸收液于试管中滴加3moL.L-1H2SO4,至溶液呈酸性,然后将所得溶液分置于A、B试管中. | 无明显现象 |
| 步骤2:在A试管中滴加紫色石蕊试液 | 若先变红后褪色,证明有ClO-,否则无 |
| 步骤3:在B试管中滴加0.01mol•L-1KMnO4溶液 | 若紫红色褪去,证明有SO32-,否则无 |
2.常温下,某溶液X由Fe3+、SO42-、Cu2+、Na+、CO32-、Al3+中的几种离子组成.取少量待测液滴加KSCN溶液,溶液变红;另取少量待测滴加NaOH溶液至pH=4后过滤,向滤液中继续滴加NaOH溶液至过量时又得到沉淀W和溶液Y.可能用到的数据如下表所示,下列说法正确的是( )
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 1.9 | 4.7 | 3.4 |
| 沉淀完全的pH | 3.2 | 6.7 | 4.7 |
| A. | 该温度下Ksp[Fe(OH)3]=1×10-14.6 | |
| B. | W主要含有 Cu(OH)2和Al(OH)3 | |
| C. | 溶液X中一定含有Cu2+、Fe3+和SO42- | |
| D. | 取溶液Y进行焰色反应,可判断溶液X中是否含有Na+ |
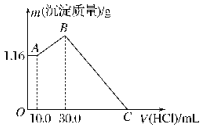 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得溶液中逐滴加入1.00mol•L-1HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答:
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得溶液中逐滴加入1.00mol•L-1HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答: 已知某反应A(g)+B(g)?C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题.
已知某反应A(g)+B(g)?C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题.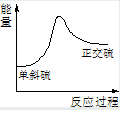
 某化学课外兴趣小组为探究铜与浓硫酸反应气体产物的性质,拟用如图所示的装置的组合进行实验.
某化学课外兴趣小组为探究铜与浓硫酸反应气体产物的性质,拟用如图所示的装置的组合进行实验.