题目内容
18.海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图1:
(1)请列举海水淡化的两种方法:蒸馏法、电渗透法或离子交换法.
(2)步骤I中己获得Br2,步骤II中又将Br2还原为Br-.其目的是富集溴元素.
(3)步骤II用SO2水溶液吸收Br2,吸收率可达95%.有关反应的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-.
(4)某化学研究性学习小组为了了解从工业溴中提纯溴的方法.查阅了有关资料知:Br2的沸点为59℃.微溶于水,有毒并有强腐蚀性.他们参观生产过程后.画了如图2装置简图:
请你参与分析讨论:
①图中仪器B的名称是冷凝管.
②整套实验装皿中仪器连接均不能用橡胶塞和橡胶管.其原因是溴具有强腐蚀性,可以腐蚀橡胶.
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?要控制温度计b的温度,并收集59℃时的馏分.
④C中液体颜色为深棕红色或红棕色.为除去该产物中仍残留的少量Cl2,可向其中加入NaBr,溶液,充分反应后.再进行的分离操作是萃取、分液.
分析 海水淡化得到氯化钠,电解氯化钠溶液或熔融状态氯化钠会生成氯气,氯气通入母液中发生反应得到低浓度的溴单质溶液,通入热空气吹出后用二氧化硫水溶液吸收得到韩HBr和的溶液,通入适量氯气氧化得到溴单质,富集溴元素,蒸馏得到工业溴,
(1)根据淡化海水的方法分析,根据目前淡化海水的方法有:蒸馏法、结晶法、淡化膜法、多级闪急蒸馏法等,其中最常用的是蒸馏法;
(2)海水淡化得到的母液和电解氯化钠溶液生成的氯气反应,得到的溴单质浓度低,溴单质在水中有一定的溶解性且和水反应,提取时消耗过的能源和原料,降低了经济效益;
(3)步骤II用SO2水溶液吸收Br2,是溴单质和二氧化硫发生氧化还原反应生成硫酸和溴化氢
(4)①蒸馏时,为充分冷凝,流出成分需要通过冷凝管冷却;
②因溴具有强氧化性和腐蚀性,应避免使用橡皮管;
③操作中控制关键条件是控制温度59℃,使溴单质挥发,收集馏分;
④C中液体为冷凝后的液溴,颜色为深棕红色或红棕色,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后.再进行的分离操作是萃取分液.
解答 解:(1)目前淡化海水的方法有多种,如:蒸馏法、电渗透法、离子交换法、水合物法、溶剂萃取法和冰冻法;
故答案为:蒸馏法;电渗透法或离子交换法;
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素,
故答案为:富集溴元素;
(3)二氧化硫吸收溴单质发生氧化还原反应,生成硫酸和溴化氢,反应的离子方程式为:Br2+SO2+2H2O═4H++SO42-+2Br-,
故答案为:SO2+Br2+2H2O=4H++SO42-+2Br-;
(4)①由装置图可知,提纯溴利用的原理是蒸馏,仪器B为冷凝管,故答案为:冷凝管;
②溴单质是一种强氧化剂,具有强腐蚀性易腐蚀橡胶制品,所以整套装置不能用橡胶塞和橡胶管,
故答案为:溴具有强腐蚀性,可以腐蚀橡胶;
③控制温度59℃,使溴单质挥发,并收集59℃时的馏分,通过冷凝得到呈深红棕色或红棕色的液态溴单质,
故答案为:要控制温度计b的温度,并收集59℃时的馏分;
④C中液体为冷凝后的液溴,液溴颜色为深棕红色或红棕色,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后.Cl2+2Br-=Br2+2Cl-,再进行的分离操作是加入萃取剂萃取分液,再蒸馏得到液溴,
故答案为:深红棕色;萃取、分液.
点评 本题考查物质的分离、提纯,侧重海水资源的综合利用,涉及到富集溴元素、海水提溴工艺等知识点,注意物质的分离、提纯应把握物质的性质的异同,掌握从海水中提取溴的原理为解答该题的关键,题目难度中等.

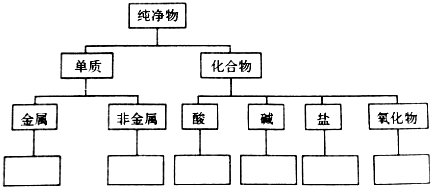
| A. |  $\stackrel{催化剂}{→}$ $\stackrel{催化剂}{→}$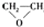 +HOCH2═O═CH2OH+2H2O +HOCH2═O═CH2OH+2H2O | B. | CH2═CH2+Cl2+Ca(OH)2? +CaCl2+H2O +CaCl2+H2O | ||
| C. | CH2═CH2+ (过氧乙酸)? (过氧乙酸)?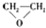 +C3HCOCH +C3HCOCH | D. | 2CH2═CH2+O2$\stackrel{催化剂}{→}$ |
| A. | 常温下0.1 mol/L的下列溶液①NH4Al(SO4)2、②NH4Cl、③NH3•H2O、④CH3COONH4溶液中,c(NH4+)由大到小的顺序是②>①>④>③ | |
| B. | 常温下0.4 mol/L CH3COOH溶液和0.2 mol/L NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度大小顺序为:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 0.1 mol/L(NH4)2Fe(SO4)2溶液:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol/L | |
| D. | 室温下,向0.1 mol/LNH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| A. | 整个过程共发生2个氧化还原反应 | |
| B. | 在该溶液中滴少量品红,品红褪色 | |
| C. | 所有离子的浓度都发生了变化 | |
| D. | 反应过程中氯气既作氧化剂又作还原剂 |
①加快化石燃料的开采与使用②研发易降解的生物农药
③应用高效洁净的能源转换技术④田间焚烧秸秆
⑤推广使用节能环保材料.
| A. | ①③⑤ | B. | ②③⑤ | C. | ①②④ | D. | ②④ |
| A. | 1 L 0.1 mol•L-1 CuSO4溶液中含有0.1NA个Cu 2+ | |
| B. | 50 mL 18.4 mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| C. | 12 g石墨烯(单层石墨)中含有C-C的个数为1.5NA | |
| D. | 孤对电子对数均为NA的H2S和H2O在标准状况下占有体积相同 |
| A. | 在墙壁刚粉刷过石灰浆的室内生一炭火盆,墙壁会“冒汗” | |
| B. | 以二氧化硅为主要原料制造光导纤维 | |
| C. | 碳炉边放盆水,可防止煤气中毒 | |
| D. | 用干冰进行人工降雨 |