题目内容
6.下列溶液中微粒的物质的量浓度关系正确的是( )| A. | 常温下0.1 mol/L的下列溶液①NH4Al(SO4)2、②NH4Cl、③NH3•H2O、④CH3COONH4溶液中,c(NH4+)由大到小的顺序是②>①>④>③ | |
| B. | 常温下0.4 mol/L CH3COOH溶液和0.2 mol/L NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度大小顺序为:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 0.1 mol/L(NH4)2Fe(SO4)2溶液:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol/L | |
| D. | 室温下,向0.1 mol/LNH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
分析 A.铝离子水解显酸性抑制铵根离子水解,醋酸根离子促进铵根离子水解,氯离子对铵根离子水解无影响,一水合氨是弱碱存在微弱的电离平衡,据此分析;
B.常温下0.4 mol/L CH3COOH溶液和0.2 mol/L NaOH溶液等体积混合得到等浓度的醋酸钠和醋酸的混合溶液,反应后溶液显酸性,说明醋酸电离程度大于醋酸根离子水解程度;
C.溶液中存在物料守恒,铵根离子水解生成一水合氨,亚铁离子水解生成氢氧化亚铁;
D.向 NH4HSO4中滴加NaOH溶液,当二者物质的量相同时,溶质为等物质的量的(NH4)2SO4和Na2SO4,溶液呈酸性,再滴加少许NaOH呈中性.
解答 解:A.①NH4Al(SO4)2 中铝离子水解溶液显酸性,Al3++3H2O?Al(OH)3+3H+,抑制铵根离子水解;
②NH4Cl是强酸弱碱盐,铵根离子能水解但较弱;
③NH3•H2O是弱电解质,电离程度较小;
④CH3COONH4中醋酸根离子促进铵根离子水解,
水解是微弱的反应过程,水解程度很小,所以铵根离子浓度大小顺序是:①>②>④>③,故A错误;
B.常温下0.4 mol/L CH3COOH溶液和0.2 mol/L NaOH溶液等体积混合得到等浓度的醋酸钠和醋酸的混合溶液,反应后溶液显酸性,说明醋酸电离程度大于醋酸根离子水解程度,溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),故B错误;
C.溶液中存在物料守恒,c(NH4+)+c(NH3•H2O)+c(Fe2+)+c(Fe(OH)2)=0.3 mol/L,故C错误;
D.NH4HSO4中滴加NaOH溶液,若二者物质的量相同时,溶质为等物质的量的(NH4)2SO 4和Na2SO 4,溶液呈酸性,需要再滴加少许NaOH呈中性,c(Na+)+c(NH4+)=2c(SO42-),故溶液中离子浓度大小关系为c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故D正确;
故选D.
点评 本题考查了盐类水解、溶液酸碱性比较、离子浓度大小判断、溶液中电荷守恒和物料守恒分析应用,掌握基础是解题关键,题目难度中等.

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案| A. | 该未知物X为NaI | |
| B. | 该反应中氧化剂与还原剂的物质的量之比为5:2 | |
| C. | 该反应中,发生氧化反应的过程是KIO3→I2 | |
| D. | 由反应可知还原性强弱顺序为:Na2SO3>I2 |
| A. | 饱和氯水中Cl-、N、Na+、S可以大量存在 | |
| B. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| C. | 向无色溶液中滴加氯水和CCl4,振荡、静置,下层溶液显紫色,说明原溶液中有I- | |
| D. | SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O═S+2I-+4H+ |
| A. | 氧化钙、熟石灰、CaO、碱性氧化物 | B. | 氢氯酸、盐酸、HCl、酸 | ||
| C. | 碳酸钠、纯碱、Na2CO3、碱 | D. | 硫酸铜、胆矾、CuSO4、盐 |
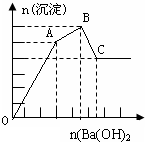 向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表.以下推断正确的是( )
向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表.以下推断正确的是( )| 氢氧化物 | 溶液pH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)3 | 2.3 | 3.4 | - | - |
| Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
| A. | AB段可能发生的反应是:2SO42-+2Ba2++Al3++3OH-═2BaSO4↓+Al(OH)3↓ | |
| B. | C点的沉淀为Fe(OH)3 | |
| C. | OA段可能发生的反应是:3Ba2++6OH-+3SO42-+Fe3++Al3+═3BaSO4↓+Fe(OH)3↓+Al(OH)3↓ | |
| D. | 据图计算原溶液中c(Cl-)>c(SO42-) |
| A. | ${\;}_{8}^{17}$O原子核内有9个质子 | |
| B. | $\stackrel{1}{1}$H原子核内有1个中子 | |
| C. | O2和O3互为同位素 | |
| D. | 通常情况下,He和N2化学性质都稳定 |
 是重要的化工原料,其合成过程如图:
是重要的化工原料,其合成过程如图:
 .
.