题目内容
3.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人使用镁片与铝片作电极,但甲同学将电极放入6mol/L的H2SO4溶液中,乙同学将电极放入6mol/L的NaOH溶液中,如图所示.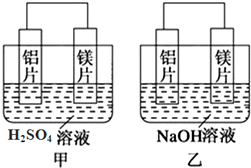
(1)甲中电池的负极是镁片,乙池中发生氧化反应的电极是铝片(填“铝片”或“镁片”).
(2)写出乙池中负极的电极反应式Al+4OH--3e-=AlO2-+2H2O.
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出Mg活动性更强,而乙会判断出Al活动性更强.(填写元素符号)
(4)上述实验也反过来证明了“直接利用金属活动性顺序判断原电池中的正负极”这种做法不可靠(填“可靠”或“不可靠”).
分析 (1)甲同学依据的化学反应原理是Mg+H2SO4=MgSO4+H2↑,乙同学依据的化学反应原理是2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)乙池中铝易失电子作负极,负极上铝失电子发生氧化反应;
(3)根据作负极的金属活泼性强结合电池中的负极判断;
(4)可以通过测电流的方向来判断原电池的正负极.
解答 解:(1)甲同学依据的化学反应原理是Mg+H2SO4=MgSO4+H2↑,则甲中负极是镁,乙同学依据的化学反应原理是2Al+2NaOH+2H2O=2NaAlO2+3H2↑,乙中发生氧化反应的是铝,
故答案为:镁片;铝片;
(2)乙池中铝易失电子作负极,负极上铝失电子发生氧化反应,电极反应式为:Al+4OH--3e-=AlO2-+2H2O,
故答案为:Al+4OH--3e-=AlO2-+2H2O;
(3)甲中镁作负极、乙中铝作负极,根据作负极的金属活泼性强判断,甲中镁活动性强、乙中铝活动性强,
故答案为:Mg;Al;
(4)上述实验说明,“直接利用金属活动性顺序表判断电池中的正负极”并不考可靠,最好是接一个电流计,通过观察电流方向判断原电池的正负极,
故答案为:不可靠.
点评 本题考查了探究原电池原理,题目难度中等,明确原电池中各个电极上发生的反应是解本题关键,注意不能根据金属的活动性强弱判断正负极,要根据失电子难易程度确定负极,为易错点.

练习册系列答案
相关题目
18.下列物质的名称、俗名、化学式及分类都一致的一组是( )
| A. | 氧化钙、熟石灰、CaO、碱性氧化物 | B. | 氢氯酸、盐酸、HCl、酸 | ||
| C. | 碳酸钠、纯碱、Na2CO3、碱 | D. | 硫酸铜、胆矾、CuSO4、盐 |
11.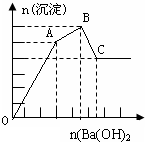 向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表.以下推断正确的是( )
向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表.以下推断正确的是( )
 向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表.以下推断正确的是( )
向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表.以下推断正确的是( )| 氢氧化物 | 溶液pH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)3 | 2.3 | 3.4 | - | - |
| Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
| A. | AB段可能发生的反应是:2SO42-+2Ba2++Al3++3OH-═2BaSO4↓+Al(OH)3↓ | |
| B. | C点的沉淀为Fe(OH)3 | |
| C. | OA段可能发生的反应是:3Ba2++6OH-+3SO42-+Fe3++Al3+═3BaSO4↓+Fe(OH)3↓+Al(OH)3↓ | |
| D. | 据图计算原溶液中c(Cl-)>c(SO42-) |
12.如图装置就用于实验室制取NH3,并用AlCl3溶液吸收多余氨气制氢氧化铝,最后回收氯化铵的实验,能达到实验目的是( )
| A. | 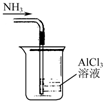 吸收NH3制取Al(OH)3 | |
| B. |  在不断搅拌下分离Al(OH)3和NH4Cl溶液 | |
| C. | 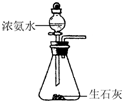 制取NH3 | |
| D. |  蒸干NH4Cl溶液并灼烧制NH4Cl |
13.下列关于聚丙烯酸酯(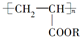 )的说法中,不正确的是( )
)的说法中,不正确的是( )
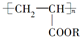 )的说法中,不正确的是( )
)的说法中,不正确的是( )| A. | 合成它的小分子化合物是CH3-CH2-COOR | |
| B. | 它可由CH2═CH-COOR经过加成聚合反应而得到 | |
| C. | 在一定条件下能发生水解反应 | |
| D. | 不能发生加成反应 |
 请按要求回答下列问题.
请按要求回答下列问题.
