题目内容
7.设NA为阿伏加德罗常数值.下列有关叙述正确的是( )| A. | 1 L 0.1 mol•L-1 CuSO4溶液中含有0.1NA个Cu 2+ | |
| B. | 50 mL 18.4 mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| C. | 12 g石墨烯(单层石墨)中含有C-C的个数为1.5NA | |
| D. | 孤对电子对数均为NA的H2S和H2O在标准状况下占有体积相同 |
分析 A、铜离子为弱碱阳离子,在溶液中会水解;
B、铜只能和浓硫酸反应,和稀硫酸不反应;
C、石墨中每个C原子与其它3个C原子成键,则平均每个C原子成键数目为3×$\frac{1}{2}$=1.5个;
D、标况下水为液态.
解答 解:A、铜离子为弱碱阳离子,在溶液中会水解,故溶液中的铜离子的个数小于0.1NA个,故A错误;
B、铜只能和浓硫酸反应,和稀硫酸不反应,故当硫酸变稀后,反应即停止,故生成的二氧化硫分子个数小于0.46NA个,故B错误;
C、石墨中每个C原子与其它3个C原子成键,则平均每个C原子成键数目为3×$\frac{1}{2}$=1.5个,则12g石墨含C原子的物质的量为1mol,则C-C键的个数为1.5NA,故C正确;
D、标况下水为液态,故孤对电子对数均为NA的H2S和H2O在标准状况下占有体积不同,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
1.下列有关说法正确的是( )
| A. | 饱和氯水中Cl-、N、Na+、S可以大量存在 | |
| B. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| C. | 向无色溶液中滴加氯水和CCl4,振荡、静置,下层溶液显紫色,说明原溶液中有I- | |
| D. | SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O═S+2I-+4H+ |
12.如图装置就用于实验室制取NH3,并用AlCl3溶液吸收多余氨气制氢氧化铝,最后回收氯化铵的实验,能达到实验目的是( )
| A. | 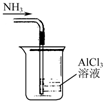 吸收NH3制取Al(OH)3 | |
| B. | 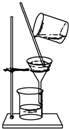 在不断搅拌下分离Al(OH)3和NH4Cl溶液 | |
| C. | 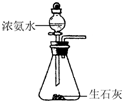 制取NH3 | |
| D. |  蒸干NH4Cl溶液并灼烧制NH4Cl |
16.1919年,科学家实现了人类多年的梦想--人工转变元素.这个核反应如下:$\stackrel{14}{7}$N+$\stackrel{4}{2}$He→${\;}_{8}^{17}$O+$\stackrel{1}{1}$H,下列有关叙述正确的是( )
| A. | ${\;}_{8}^{17}$O原子核内有9个质子 | |
| B. | $\stackrel{1}{1}$H原子核内有1个中子 | |
| C. | O2和O3互为同位素 | |
| D. | 通常情况下,He和N2化学性质都稳定 |

 ,它配以辅料丙二醇溶成针剂用于临1,3,5
,它配以辅料丙二醇溶成针剂用于临1,3,5