题目内容
6.用1L1.0mol•L-1NaOH溶液吸收0.6molCO2,所得溶液中的CO32-和HCO3-的物质的量浓度之比为( )| A. | 1:3 | B. | 1:2 | C. | 2:1 | D. | 3:2 |
分析 用1L1mol•L-1NaOH溶液吸收0.6molCO2,生成Na2CO3和NaHCO3,则NaOH、CO2完全反应,根据钠离子、碳原子守恒列方程计算Na2CO3和NaHCO3的物质的量,浓度之比等于其物质的量之比.
解答 解:用1L1mol•L-1NaOH溶液吸收0.6molCO2,生成Na2CO3和NaHCO3,则NaOH、CO2完全反应,
令Na2CO3和NaHCO3的物质的量分别为xmol、ymol,
根据钠离子守恒有:2x+y=1×1
根据碳原子守恒有:x+y=0.6
联立方程,解得x=0.4,y=0.2
所得溶液中的CO32-和HCO3-的物质的量浓度之比约为0.4mol:0.2mol=2:1,
故选:C.
点评 本题考查根据方程式的有关计算,难度不大,清楚发生的反应是关键,注意利用守恒思想进行的解答.

练习册系列答案
相关题目
5.下列关于硝酸的说法正确的是( )
| A. | 将分别蘸有浓硝酸和浓氨水的玻璃棒相互靠近时,有白烟生成 | |
| B. | 硝酸具有酸的通性,如果与活泼金属反应,会有H2生成 | |
| C. | 浓硝酸能使活泼金属如铝、镁、锌、铁等发生“钝化” | |
| D. | 常温下,铜与稀HNO3反应很慢,是因为发生了“钝化” |
6.某有机物A的结构简式如图所示,有关叙述中正确的是( )
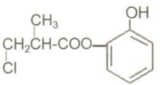

| A. | 有机物A与浓硫酸混合加热,可以发生消去反应 | |
| B. | 1molA和足量的H2发生加成反应,最多可以消耗4molH2 | |
| C. | 1molA和足量NaOH溶液发生反应,最多可以消耗 4molNaOH | |
| D. | 有机物A不能在稀硫酸下水解 |
3.下列实验中,实验现象或结论不正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向KBr溶液中加入CCl4和氯水 | CCl4层呈红色 | 氧化性:Cl2>Br2 |
| B | 向难溶的PbSO4加入CH3COONH4溶液 | 得到无色溶液 | (CH3COO)2Pb是弱电解质 |
| C | 向KNO3和KOH的混合溶液中加入Al,微热,关口放湿润的红色石蕊试剂 | 试剂变为蓝色 | NO3-被还原为NH3 |
| D | 高温加热炭粉于Fe2O3的混合物 | 产物能被磁铁吸引 | 产物中含有Fe或Fe3O4中的一种或两种 |
| A. | A | B. | B | C. | C | D. | D |
1.常温下某溶液中由水电离产生的[H+]=1×10-5mol•L-1,则下列叙述正确的是( )
| A. | 一定是碱溶液 | B. | 一定是酸溶液 | ||
| C. | 由水电离出的[OH-]=1×10-9mol•L-1 | D. | pH值可能为9也可能为5 |
18.下列熔、沸点高低的比较不正确的是( )
| A. | 金刚石>碳化硅>晶体硅 | B. | 邻羟基苯甲酸>对羟基苯甲酸 | ||
| C. | 纯铁>生铁 | D. | MgO>MgCl2 |
15.下列说法正确的是( )
| A. | 氢气的燃烧热为285.5KJ/mol,则电解水的热化学方程式为2H2O(l)$\frac{\underline{\;电解\;}}{\;}$ 2H2(g)+O2(g)△H=+285.5KJ/mol | |
| B. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ/mol 则稀H2SO4溶液和稀Ba(OH)2溶液反应的反应热△H=2×(-57.3)KJ/mol | |
| C. | 在CO2中,Mg燃烧生成MgO和C,该反应中化学能全都转化为热能 | |
| D. | 已知AX3的熔点和沸点分别为一93.6℃和76℃,AX5的熔点为167℃.室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 KJ/mol.该反应的热化学方程式为AX3(l)+X2(g)═AX5(s)△H=一123.8 KJ/mol |
16.在下列指定条件的溶液中,一定能大量共存的离子组是( )
| A. | K2S溶液中:SO42-、K+、Cl-、Cu2+ | |
| B. | 无色溶液中:Fe2+、Na+、ClO-、Cl- | |
| C. | 室温下,$\frac{KW}{c({H}^{+})}$=0.1mol•L-1的溶液中:Na+、K+、SiO32-、NO3- | |
| D. | 滴入KSCN溶液显红色的溶液中:K+、Na+、SO42-、C6H5OH |