题目内容
1.常温下某溶液中由水电离产生的[H+]=1×10-5mol•L-1,则下列叙述正确的是( )| A. | 一定是碱溶液 | B. | 一定是酸溶液 | ||
| C. | 由水电离出的[OH-]=1×10-9mol•L-1 | D. | pH值可能为9也可能为5 |
分析 常温下某溶液中由水电离产生的[H+]=1×10-5mol/L,说明水的电离被促进,依据影响水电离平衡的因素,升温促进电离,酸碱抑制水的电离,能水解的盐促进水的电离.
解答 解:A、常温下某溶液中由水电离产生的[H+]=1×10-5mol/L,说明水的电离被促进,则一定不能是碱溶液,故A错误;
B、酸溶液抑制水的电离,所以一定不是酸溶液,故B错误;
C、水电离出的氢离子和氢氧根的浓度永远相等,故由水电离出的[OH-]=1×10-5mol•L-1,故C错误;
D、常温下某溶液中由水电离产生的[H+]=1×10-5mol/L,说明水的电离被促进,可能是水解显酸性的盐,则溶液pH=5,也可能是水解显碱性的盐,则pH=9,故D正确;
故选D.
点评 本题考查了水的电离的应用,影响水的电离的因素,主要考查盐类水解促进水的电离的溶液PH计算.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
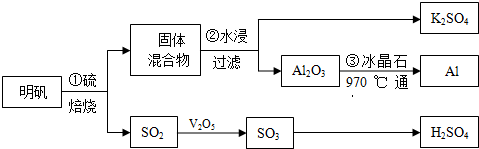
1.海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品.
(1)海水中制得的氯化钠可用于生产烧碱及氯气.反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-.
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
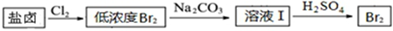
将Br2与Na2CO3反应的化学方程式补充完整:□Br2+□Na2CO3═NaBrO3+□5NaBr+□3CO2
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):
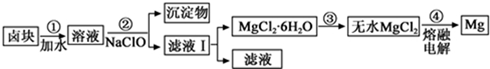
生成氢氧化物沉淀的pH
①步骤②中需控制pH=9.8,其目的是除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去.
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4H+.
③步骤③需在HCl保护气中加热进行,其原理涉及的离子方程式为Mg2++2H2O?Mg(OH)2+2H+.
④NaClO还能除去盐卤中的CO(NH2)2,生成盐类物质和能参与大气循环的物质.除去0.1mol CO(NH2)2时消耗NaClO22.35g.
(1)海水中制得的氯化钠可用于生产烧碱及氯气.反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-.
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
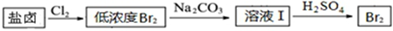
将Br2与Na2CO3反应的化学方程式补充完整:□Br2+□Na2CO3═NaBrO3+□5NaBr+□3CO2
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):

生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4H+.
③步骤③需在HCl保护气中加热进行,其原理涉及的离子方程式为Mg2++2H2O?Mg(OH)2+2H+.
④NaClO还能除去盐卤中的CO(NH2)2,生成盐类物质和能参与大气循环的物质.除去0.1mol CO(NH2)2时消耗NaClO22.35g.
6.用1L1.0mol•L-1NaOH溶液吸收0.6molCO2,所得溶液中的CO32-和HCO3-的物质的量浓度之比为( )
| A. | 1:3 | B. | 1:2 | C. | 2:1 | D. | 3:2 |
13.某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种,现将6.9g样品溶于足量水中,得到澄清溶液,若再加入过量的CaCl2溶液,得到4.0g沉淀,对样品所含杂质的正确判断是( )
| A. | 肯定有KNO3和Na2CO3,没有Ba(NO3)2 | |
| B. | 肯定有KNO3,没有Ba(NO3)2,可能还有Na2CO3 | |
| C. | 肯定没有Na2CO3和Ba(NO3)2,可能有KNO3 | |
| D. | 以上判断都不正确 |
11.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,48gO3中所含的氧原子数为3NA | |
| B. | 1.8gNH4+中所含质子数为0.1NA | |
| C. | 标况下,11.2L氧气中所含原子数为0.5NA | |
| D. | 2.4g金属镁变成离子时得到的电子数为0.2NA |