题目内容
9. 研究硫元素及其化合物的性质具有重要意义.
研究硫元素及其化合物的性质具有重要意义.(1)加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
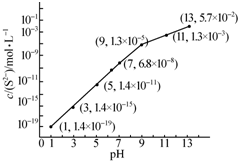
(2)25℃,在0.10mol•L-1 H2S溶液中,通入HCl气体或加入NaOH 固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1 Mn2+、0.10mol•L-1 H2S,当溶液pH=5时,Mn2+开始沉淀[已知:Ksp(MnS)=2.8×10-13].
(3)25℃,两种酸的电离平衡常数如表.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②0.10mol•L-1 Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
分析 (1)加热时,硫元素的最高价氧化物对应水化物的浓溶液是浓硫酸与木炭反应生成二氧化碳、二氧化硫和水;
(2)①pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1;
②当Qc=Ksp(MnS)时开始沉淀,由此求出硫离子的浓度,结合图象得出此时的pH;
(3)①HSO3-的电离方程式为:HSO3-?H++SO32-,平衡常数表达式为K=$\frac{c({H}^{+})c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$;
②Na2SO3溶液显碱性,SO32-存在两步水解,以第一步水解为主,水解程度较小,据此判断离子浓度关系;
③由表可知H2SO3的二级电离大于H2CO3的一级电离,则酸性强弱H2SO3>H2CO3>HSO3-,所以反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O,而不是为H2SO3+2HCO3-=SO32-+2CO2↑+2H2O.
解答 解:(1)加热时,硫元素的最高价氧化物对应水化物的浓溶液是浓硫酸与木炭反应生成二氧化碳、二氧化硫和水,反应的方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
(2)①pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1,所以c(H2S)+c(HS-)=0.1-5.7×10-2=0.043mol/L,故答案为:0.043;
②当Qc=Ksp(MnS)时开始沉淀,所以c(S2-)=$\frac{Ksp(MnS)}{c(M{n}^{2+})}$=$\frac{2.8×1{0}^{-13}}{0.020}$=1.4×10-11mol/L,结合图象得出此时的pH=5,所以pH=5时锰离子开始沉淀,
故答案为:5;
(3)①HSO3-的电离方程式为:HSO3-?H++SO32-,平衡常数表达式为K=$\frac{c({H}^{+})c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$,
故答案为:$\frac{c({H}^{+})c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$;
②Na2SO3溶液显碱性,SO32-存在两步水解:SO32-+H2O?HSO3-+OH-,HSO3-+H2O?H2SO3+OH-,以第一步水解为主,水解程度较小,则0.1mol/L Na2SO3溶液中的离子浓度顺序为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),
故答案为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
③由表可知H2SO3的二级电离大于H2CO3的一级电离,所以酸性强弱H2SO3>H2CO3>HSO3-,所以反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O,而不是为H2SO3+2HCO3-=SO32-+2CO2↑+2H2O.
故答案为:H2SO3+HCO3-=HSO3-+CO2↑+H2O.
点评 本题考查元素原子结构示意图的书写、物质性质的化学方程式书写、盐的水解平衡、弱电解质电离平衡、沉淀溶解平衡的知识在离子浓度大小比较的应用,题目难度中等.

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案| A. | 新戊烷 C(CH3)4 | B. | 3-乙基-1-丁烯 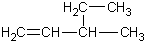 | ||
| C. | 2-甲基-2,4-己二烯 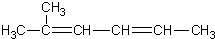 | D. | 2,2,3-三甲基戊烷 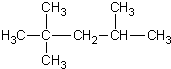 |
| A. | 常温常压下,0.1molC3H8所含有的共价键数目为1.1 NA | |
| B. | 1mol苯分子中,含有碳碳双键的数目为3 NA | |
| C. | 常温常压下,15g甲基(-CH3)所含的电子数为10NA | |
| D. | 现有乙烯、丙烯的混合气体共14 g,其原子数为3NA |

| A. | 分子式为C2H4O2的有机化合物性质相同 | |
| B. | 由如图可得H2O2分解的热化学方程式为2H2O2(aq)═2H2O(l)+O2(g),△H=(E1-E2)kJ•mol-1 | |
| C. | Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 | |
| D. | Na2O2与CO2反应产生1 mol O2理论上转移的电子数约为26.02×1023 |
| A. | 3Cl2(g)+8NH3(g)═6NH4Cl(s)+N2(g)在常温下能自发进行,则该反应的△H<0 | |
| B. | 电解精炼铜时,电解液中CuSO4的物质的量浓度不变 | |
| C. | 室温下,体积、pH均相同的HA和HB两种酸分别与足量的锌反应,HA放出氢气多,说明酸性:HB>HA | |
| D. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
| A. | 1mol O2(g)的能量一定高于2mol SO2(g)的能量 | |
| B. | 2mol SO2(g)和1mol O2(g)的总能量一定高于2mol SO3(g)的总能量 | |
| C. | 2mol SO2(g)的能量一定高于2mol SO3(g)的能量 | |
| D. | 因该反应为放热反应,故不必加热就可发生 |
| A. | 乙醇的分子式:CH3CH2OH | B. | CH3COCH3的官能团名称:醚键 | ||
| C. | 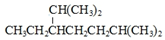 的名称为:2,6-二甲基-3-乙基庚烷 的名称为:2,6-二甲基-3-乙基庚烷 | D. | 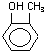 的类别:醇类 的类别:醇类 |
| A. | ${\;}_{34}^{78}$Se与${\;}_{34}^{80}$Se都含有34个中子 | |
| B. | ${\;}_{34}^{78}$Se与${\;}_{34}^{80}$Se分别含有44和46个质子 | |
| C. | ${\;}_{34}^{78}$Se与${\;}_{34}^{80}$Se因含有相同的质子数故互为同位素 | |
| D. | ${\;}_{34}^{78}$Se与${\;}_{34}^{80}$Se含有相同的电子数,因此性质一样 |

 .
. .
.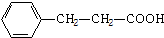 .
. 单体.
单体.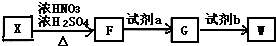
 ,试剂a为酸性KMnO4 溶液.
,试剂a为酸性KMnO4 溶液.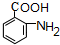 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +(n-1)H2O.
+(n-1)H2O.