题目内容
17.下列说法正确的是( )
| A. | 分子式为C2H4O2的有机化合物性质相同 | |
| B. | 由如图可得H2O2分解的热化学方程式为2H2O2(aq)═2H2O(l)+O2(g),△H=(E1-E2)kJ•mol-1 | |
| C. | Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 | |
| D. | Na2O2与CO2反应产生1 mol O2理论上转移的电子数约为26.02×1023 |
分析 A、子式为C2H4O2的有机化合物可能是酸也可能是酯;
B、由如图可得H2O2分解的热化学方程式为2H2O2(aq)═2H2O(l)+O2(g),△H=-2(E1-E2)kJ•mol-1;
C、Al2O3是两性氧化物与烧碱反应;
D、Na2O2与CO2反应Na2O2既是氧化剂又是还原剂.
解答 解:A、子式为C2H4O2的有机化合物可能是酸也可能是酯,所以化学性质不同,故A错误;
B、由如图可得H2O2分解的热化学方程式为2H2O2(aq)═2H2O(l)+O2(g),△H=-2(E1-E2)kJ•mol-1,故B错误;
C、Al2O3是两性氧化物与烧碱反应,所以不能用氧化铝制造熔融烧碱的坩埚,故C错误;
D、Na2O2与CO2反应Na2O2既是氧化剂又是还原剂,所以产生1 mol O2理论上转移的电子数约为6.02×1023,故D正确;
故选D.
点评 本题考查热化学反应方程式及能量变化图象,明确图象中纵横坐标的含义及点、线、面的意义是解答本题的关键,题目难度不大.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
5.下列反应的离子方程式书写正确的是( )
| A. | 铜溶于0.5 mol﹒L-1的硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| B. | 工业上将Cl2通入石灰乳中制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 向Ba(OH)2溶液中加入少量的NH4HSO4溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 1.0mol/L的NaAlO2溶液和2.5mol/L的盐酸等体积混合:2AlO2-+5H+═Al3++Al(OH)3↓+H2O |
2.下列指定反应的离子方程式正确的是( )
| A. | [Ag(NH3)2]OH的溶液中加入盐酸:Ag++Cl-═AgCl↓ | |
| B. | NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- | |
| C. | 用Na2S2O3溶液吸收自来水中多余Cl2:4Cl2+S2O32-+5H2O═10H++2SO42-+8Cl- | |
| D. | 向酸性KMnO4溶液滴加H2C2O4(弱酸),溶液褪色:2MnO4++5H2C2O4═2Mn2++10CO2↑+2H2O+6OH- |
9. 研究硫元素及其化合物的性质具有重要意义.
研究硫元素及其化合物的性质具有重要意义.
(1)加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
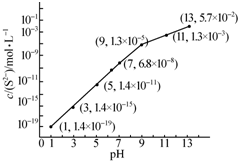
(2)25℃,在0.10mol•L-1 H2S溶液中,通入HCl气体或加入NaOH 固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1 Mn2+、0.10mol•L-1 H2S,当溶液pH=5时,Mn2+开始沉淀[已知:Ksp(MnS)=2.8×10-13].
(3)25℃,两种酸的电离平衡常数如表.
①HSO3-的电离平衡常数表达式K=$\frac{c({H}^{+})c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$.
②0.10mol•L-1 Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
 研究硫元素及其化合物的性质具有重要意义.
研究硫元素及其化合物的性质具有重要意义.(1)加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(2)25℃,在0.10mol•L-1 H2S溶液中,通入HCl气体或加入NaOH 固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1 Mn2+、0.10mol•L-1 H2S,当溶液pH=5时,Mn2+开始沉淀[已知:Ksp(MnS)=2.8×10-13].
(3)25℃,两种酸的电离平衡常数如表.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②0.10mol•L-1 Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
1.在合成氨反应中,由a mol N2和b mol H2混合反应达到平衡时,有c mol NH3生成,则NH3在反应混合物中所占的体积分数是( )
| A. | $\frac{100c}{a+b}$% | B. | $\frac{a}{a+b+c}$×100% | C. | $\frac{100c}{a+b-c}$% | D. | $\frac{100c}{a+b-\frac{c}{2}}$% |
 X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是形成酸雨的主要气体之一;Z基态原子的M层与K层电子数相等;R2+的3d轨道有9个电子.请回答下列问题:
X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是形成酸雨的主要气体之一;Z基态原子的M层与K层电子数相等;R2+的3d轨道有9个电子.请回答下列问题: