题目内容
18.以下化学用语正确的是( )| A. | 乙醇的分子式:CH3CH2OH | B. | CH3COCH3的官能团名称:醚键 | ||
| C. |  的名称为:2,6-二甲基-3-乙基庚烷 的名称为:2,6-二甲基-3-乙基庚烷 | D. |  的类别:醇类 的类别:醇类 |
分析 A、分子式是表示物质元素组成的式子;
B、CH3COCH3的官能团为羰基;
C、烷烃命名时,要选最长的碳链为主链,从离支链近的一端给主链上碳原子编号,据此分析;
D、当-OH直接连在苯环上时为酚类.
解答 解:A、分子式是表示物质元素组成的式子,故乙醇的分子式为C2H6O,故A错误;
B、CH3COCH3的官能团为羰基,而不是醚键,故B错误;
C、烷烃命名时,要选最长的碳链为主链,当有多条主链可选时,要选支链多的一条,故主链上有7个碳原子,从离支链近的一端给主链上碳原子编号,当两端离支链一样近时,要从支链多的一端开始编,故在2号和6号碳原子上有各一个甲基,在3号碳原子上有一个乙基,故名称为:2,6-二甲基-3-乙基庚烷,故C正确;
D、当-OH直接连在苯环上时为酚类,只有当-OH连在链烃基或苯环侧链上时为醇类,故D错误.
故选C.
点评 本题考查了分子式和结构简式的区别、有机物官能团的名称和烷烃的命名以及有机物的类别,难度不大,注意掌握有机物的官能团是关键.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
9. 研究硫元素及其化合物的性质具有重要意义.
研究硫元素及其化合物的性质具有重要意义.
(1)加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
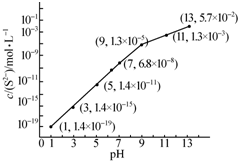
(2)25℃,在0.10mol•L-1 H2S溶液中,通入HCl气体或加入NaOH 固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1 Mn2+、0.10mol•L-1 H2S,当溶液pH=5时,Mn2+开始沉淀[已知:Ksp(MnS)=2.8×10-13].
(3)25℃,两种酸的电离平衡常数如表.
①HSO3-的电离平衡常数表达式K=$\frac{c({H}^{+})c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$.
②0.10mol•L-1 Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
 研究硫元素及其化合物的性质具有重要意义.
研究硫元素及其化合物的性质具有重要意义.(1)加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(2)25℃,在0.10mol•L-1 H2S溶液中,通入HCl气体或加入NaOH 固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1 Mn2+、0.10mol•L-1 H2S,当溶液pH=5时,Mn2+开始沉淀[已知:Ksp(MnS)=2.8×10-13].
(3)25℃,两种酸的电离平衡常数如表.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②0.10mol•L-1 Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
13.下列有关化学实验原理、操作以及现象预测和结论的叙述正确的是
 ( )
( )
 ( )
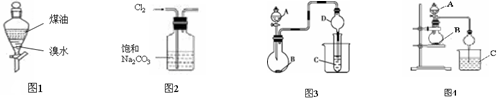
( )| A. | 利用图1完成“用煤油来萃取溴水中的Br2”,充分振荡后静置,上层变橙红色,下层几乎无色 | |
| B. | 实验室制取纯净Cl2,可用图2装置除去Cl2中的HCl气体杂质 | |
| C. | 图3中,若A、B、C分别为浓硫酸、Na2SO3固体、石蕊溶液,则C中溶液先变红后褪色 | |
| D. | 图4中,若A为浓氨水,B为生石灰,C硝酸银稀溶液,实验中可看到C中先变浑浊后变澄清,说明AgOH具有两性 |
3.下列洗涤方法主要利用了物质化学性质的是( )
| A. | 无水酒精洗手机屏幕 | B. | 食醋洗去水壶内的水垢 | ||
| C. | 清水洗涤衣服上的食盐 | D. | 汽油洗涤衣服上的油迹 |
10.小苏打(主要成分为NaHCO3)中常含有少量氯化钠.化学兴趣小组的同学为了测定某品牌小苏打中NaHCO3的质量分数.进行了以下实验:
称量样品置于烧杯中,向其中慢慢滴加稀盐酸,至不再产生气泡为止,测得的有关数据如表所示.
试计算:(计算结果保留一位小数)
(1)样品中的NaHCO3质量分数;
(2)所得溶液中NaCl的质量分数.
称量样品置于烧杯中,向其中慢慢滴加稀盐酸,至不再产生气泡为止,测得的有关数据如表所示.
| 物 质 | 样 品 | 消耗稀盐酸质量 | 反应后溶液质量 |
| 质量(g) | 9 | 75.4 | 80 |
(1)样品中的NaHCO3质量分数;
(2)所得溶液中NaCl的质量分数.
1.在合成氨反应中,由a mol N2和b mol H2混合反应达到平衡时,有c mol NH3生成,则NH3在反应混合物中所占的体积分数是( )
| A. | $\frac{100c}{a+b}$% | B. | $\frac{a}{a+b+c}$×100% | C. | $\frac{100c}{a+b-c}$% | D. | $\frac{100c}{a+b-\frac{c}{2}}$% |
2.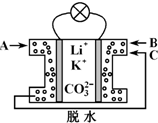 熔融碳酸盐燃料电池是一种高温电池,具有效率高、噪音低、无污染、燃料多样化、余热利用价值高和电池构造材料价廉等诸多优点,是未来的绿色电站.某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图.下列说法正确的是( )
熔融碳酸盐燃料电池是一种高温电池,具有效率高、噪音低、无污染、燃料多样化、余热利用价值高和电池构造材料价廉等诸多优点,是未来的绿色电站.某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图.下列说法正确的是( )
 熔融碳酸盐燃料电池是一种高温电池,具有效率高、噪音低、无污染、燃料多样化、余热利用价值高和电池构造材料价廉等诸多优点,是未来的绿色电站.某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图.下列说法正确的是( )
熔融碳酸盐燃料电池是一种高温电池,具有效率高、噪音低、无污染、燃料多样化、余热利用价值高和电池构造材料价廉等诸多优点,是未来的绿色电站.某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图.下列说法正确的是( )| A. | Li+、K+移向左侧电极 | |
| B. | 外电路中电子由右侧电极移向左侧电极 | |
| C. | 通入1 mol气体A时,左侧电极上生成5 mol CO2 | |
| D. | 相同条件下通入气体B与气体C的体积比为2:1 |