题目内容
14.芳香烃X,相对分子质量为92.以X为初始原料合成E,路线如图(部分产物和反应条件已略去).
回答下列问题:
(1)有机物X的结构简式为
 .
.(2)A→B的反应条件为NaOH水溶液、加热.
(3)C→D转化中①的化学方程式为
 .
.(4)下列关于B的说法正确的是ac.
a.核磁共振氢谱有5个峰b.能发生消去反应和还原反应
c.能与钠反应放出氢气d.能和NaOH溶液反应
(5)E有多种同分异构体,同时符合下列条件的同分异构体共有14种.
①遇NaHCO3溶液有气体放出 ②芳香族化合物
其中不含甲基的有机物的结构简式为
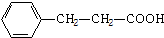 .
.(6)有机物X可通过三步合成W,W是高分子化合物
 单体.
单体.已知:I.苯环上的甲基可以被酸性KMnO4氧化成羧基
II.苯环侧链的硝基可被Fe/HCl还原为氨基,苯环侧链的氨基易被氧化
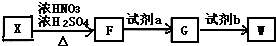
①F的结构简式为
 ,试剂a为酸性KMnO4 溶液.
,试剂a为酸性KMnO4 溶液.②在一定条件下W聚合成高分子化合物的化学方程式为n
 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +(n-1)H2O.
+(n-1)H2O.
分析 相对分子质量为92的某芳香烃X,令分子组成为CxHy,则$\frac{92}{12}$=7…8,由烷烃中C原子与H原子关系可知,该烃中C原子数目不能小于7,故该芳香烃X的分子式为C7H8,其结构简式为 ,X与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,则A为
,X与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,则A为 ,B为
,B为 ,C为
,C为 ,D为
,D为 ,苯甲酸与乙醇发生酯化反应生成E为
,苯甲酸与乙醇发生酯化反应生成E为 .
.
(6)由高分子化合物的结构简式,逆推可知W为 ,
, 在浓硫酸、加热条件下与浓硝酸发生取代反应生成F为
在浓硫酸、加热条件下与浓硝酸发生取代反应生成F为 ,F转化生成G,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,G为
,F转化生成G,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,G为 ,G与Fe/HCl反应生成W.
,G与Fe/HCl反应生成W.
解答 解:相对分子质量为92的某芳香烃X,令分子组成为CxHy,则$\frac{92}{12}$=7…8,由烷烃中C原子与H原子关系可知,该烃中C原子数目不能小于7,故该芳香烃X的分子式为C7H8,其结构简式为 ,X与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,则A为
,X与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,则A为 ,B为
,B为 ,C为
,C为 ,D为
,D为 ,苯甲酸与乙醇发生酯化反应生成E为
,苯甲酸与乙醇发生酯化反应生成E为 .
.
(1)有机物X的结构简式为: ,故答案为:
,故答案为: ;
;
(2)A→B发生卤代烃水解反应,反应条件为:NaOH水溶液、加热,故答案为:NaOH水溶液、加热;
(3)C→D转化中①是 与银氨溶液发生氧化反应生成
与银氨溶液发生氧化反应生成 ,反应方程式为:
,反应方程式为:
故答案为: ;
;
(4)下列关于B( )的说法:
)的说法:
a.分子中含有5种H原子,核磁共振氢谱有5个峰,故a正确;
b.能与氢气发生加成反应,属于还原反应,不能发生消去反应,故b错误;
c.含有醇羟基,能与钠反应放出氢气,故c正确;
d.醇羟基不能和NaOH溶液反应,故d错误,
故选:ac;
(5)E( )的同分异构体同时符合下列条件:
)的同分异构体同时符合下列条件:
①遇NaHCO3溶液有气体放出,说明含有羧基,②芳香族化合物,说明含有苯环,含有一个取代基为-CH2CH2COOH或者-CH(CH3)COOH,含有2个取代基为-CH3、-CH2COOH,或者-CH2CH3、-COOH,各有邻、间、对3种,含有3个取代基为2个-CH3、-COOH,2个-CH3处于邻位,-COOH有2种位置,2个-CH3处于间位,-COOH有3种位置,2个-CH3处于对位,-COOH有1种位置,共有14种,其中不含甲基的有机物的结构简式为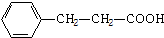 ,
,
故答案为:14;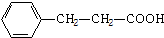 ;
;
(6)由高分子化合物的结构简式,逆推可知W为 ,
, 在浓硫酸、加热条件下与浓硝酸发生取代反应生成F为
在浓硫酸、加热条件下与浓硝酸发生取代反应生成F为 ,F转化生成G,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,G为
,F转化生成G,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,G为 ,G与Fe/HCl反应生成W.
,G与Fe/HCl反应生成W.
①F的结构简式为: ,试剂a为:酸性KMnO4 溶液,故答案为:
,试剂a为:酸性KMnO4 溶液,故答案为: ;酸性KMnO4 溶液;
;酸性KMnO4 溶液;
②在一定条件下W聚合成高分子化合物的化学方程式为:n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +(n-1)H2O,
+(n-1)H2O,
故答案为:n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +(n-1)H2O.
+(n-1)H2O.
点评 本题考查有机物的推断与合成,难度中等,关键是利用X的相对分子质量推断X的结构,结合A的反应产物的B可以连续发生氧化反应判断A的结构,再根据反应条件及反应信息进行判断,是对有机物知识的综合考查,能较好的考查学生的分析思维能力,是有机热点题型.

| A. | 铜溶于0.5 mol﹒L-1的硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| B. | 工业上将Cl2通入石灰乳中制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 向Ba(OH)2溶液中加入少量的NH4HSO4溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 1.0mol/L的NaAlO2溶液和2.5mol/L的盐酸等体积混合:2AlO2-+5H+═Al3++Al(OH)3↓+H2O |
| A. | [Ag(NH3)2]OH的溶液中加入盐酸:Ag++Cl-═AgCl↓ | |
| B. | NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- | |
| C. | 用Na2S2O3溶液吸收自来水中多余Cl2:4Cl2+S2O32-+5H2O═10H++2SO42-+8Cl- | |
| D. | 向酸性KMnO4溶液滴加H2C2O4(弱酸),溶液褪色:2MnO4++5H2C2O4═2Mn2++10CO2↑+2H2O+6OH- |
 研究硫元素及其化合物的性质具有重要意义.
研究硫元素及其化合物的性质具有重要意义.(1)加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
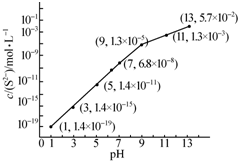
(2)25℃,在0.10mol•L-1 H2S溶液中,通入HCl气体或加入NaOH 固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1 Mn2+、0.10mol•L-1 H2S,当溶液pH=5时,Mn2+开始沉淀[已知:Ksp(MnS)=2.8×10-13].
(3)25℃,两种酸的电离平衡常数如表.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②0.10mol•L-1 Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
| A. | 单质的颜色随核电荷数的增加而加深 | |
| B. | 单质的熔、沸点随核电荷数的增加而升高 | |
| C. | 它们的氢化物的还原性随核电荷数的增加而增强 | |
| D. | 它们的氢化物的稳定性随核电荷数的增加而增强 |
| A. | 无水酒精洗手机屏幕 | B. | 食醋洗去水壶内的水垢 | ||
| C. | 清水洗涤衣服上的食盐 | D. | 汽油洗涤衣服上的油迹 |
| A. | X3Y2 | B. | X2Y | C. | X2Y5 | D. | XY3 |
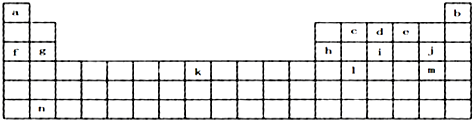
 ,元素c在周期表的位置第二周期IVA族
,元素c在周期表的位置第二周期IVA族