题目内容
5.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列符合未来新能源标准的是( )①天然气 ②煤 ③氢能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能.
| A. | 仅①③⑤⑥ | B. | 仅③⑤⑥⑦ | C. | 仅⑤⑥⑦ | D. | 仅③④⑥⑦ |
分析 煤、石油、天然气是化石燃料,而太阳能、核能、地热能、潮汐能、风能、氢能、生物质能等都是新能源,以此来解答.
解答 解:①天然气、②煤、④石油属于化石能源;
③氢能、⑤太阳能、⑥生物质能、⑦风能符合未来新能源标准,为新能源,
故选B.
点评 本题考查能源及分类,为高频考点,把握能源的使用及对环境的污染为解答的关键,侧重分析与应用能力的考查,注意能源、环境与化学的联系,题目难度不大.

练习册系列答案
相关题目
15.氨是生产硝酸、尿素等物质的重要原料,工业合成氨是最重要的化工生产之一.
(1)氨催化氧化法是工业制硝酸的主要方法.已知已知:2NO(g)+3H2(g)?2NH3(g)+O2(g)△H1=-272.9kJ•mol-1,2H2(g)+O2(g)═2H2O(g)△H2=-483.6kJ•mol-1,则4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H3=-905.0KJ•mol-1.
(2)恒容密闭容器中进行合成氨反应N2(g)+3H2(g)?2NH3(g)△H4=-92.4kJ•mol-1,其化学平衡常数(K)与温度的关系如表:
K1> K2(填“>”或“<”),其判断理由是该反应为放热反应,温度升高,平衡逆向移动,平衡常数减小.
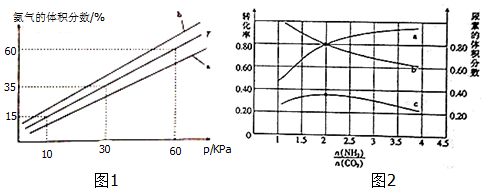
(3)向氨合成塔中充入10molN2和40mol H2进行氨的合成,一定温度(T)下平衡混合物中氨气的体积分数与压强(p)的关系如图1所示.下列说法正确的是 (填字母).AB
A.由图可知增大体系压强(p),有利于增大氨气在混合气体中的体积分数
B.若图中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高氮气的转化率
D.当3v正(H2)=2v逆(NH3)时,反应达到平衡状态
当温度为T、氨气的体积分数为25%时,N2的转化率为50%.
(4)工业上用NH3生产硝酸时,将NH3和O2按体积比1:2混合通入某特定条件的密闭容器中进行反应,所有物质不与外界交换,最后所得溶液中溶质的质量分数为77.8%.
(5)氨碳比[n(NH3)/n(CaO2)]对合成尿素的反应:2NH3(g)+CO2(g)?CO(NH2)2(g)+H2O(g)有影响.T℃时,在一定体积为2L的恒容密闭容器中,将物质的量之和比为3mol的NH3和CO2以不容的氨碳比进行反应,结果如图2所示,a、b分别表示CO2或NH3的转化率,c表示平衡体系中尿素的体积分数.[n(NH3)/n(CO2)]=2时,尿素产量最大;该条件下反应的平衡常数K=40.

(1)氨催化氧化法是工业制硝酸的主要方法.已知已知:2NO(g)+3H2(g)?2NH3(g)+O2(g)△H1=-272.9kJ•mol-1,2H2(g)+O2(g)═2H2O(g)△H2=-483.6kJ•mol-1,则4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H3=-905.0KJ•mol-1.
(2)恒容密闭容器中进行合成氨反应N2(g)+3H2(g)?2NH3(g)△H4=-92.4kJ•mol-1,其化学平衡常数(K)与温度的关系如表:
| 温度/K | 298 | 398 | 498 | … |
| 平衡常数(K) | 4.1×105 | K1 | K2 | … |
(3)向氨合成塔中充入10molN2和40mol H2进行氨的合成,一定温度(T)下平衡混合物中氨气的体积分数与压强(p)的关系如图1所示.下列说法正确的是 (填字母).AB
A.由图可知增大体系压强(p),有利于增大氨气在混合气体中的体积分数
B.若图中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高氮气的转化率
D.当3v正(H2)=2v逆(NH3)时,反应达到平衡状态
当温度为T、氨气的体积分数为25%时,N2的转化率为50%.
(4)工业上用NH3生产硝酸时,将NH3和O2按体积比1:2混合通入某特定条件的密闭容器中进行反应,所有物质不与外界交换,最后所得溶液中溶质的质量分数为77.8%.
(5)氨碳比[n(NH3)/n(CaO2)]对合成尿素的反应:2NH3(g)+CO2(g)?CO(NH2)2(g)+H2O(g)有影响.T℃时,在一定体积为2L的恒容密闭容器中,将物质的量之和比为3mol的NH3和CO2以不容的氨碳比进行反应,结果如图2所示,a、b分别表示CO2或NH3的转化率,c表示平衡体系中尿素的体积分数.[n(NH3)/n(CO2)]=2时,尿素产量最大;该条件下反应的平衡常数K=40.
20.下列说法正确的是( )
| A. | 淀粉、纤维素、蔗糖和麦芽糖水解的最终产物都是葡萄糖 | |
| B. | 可以用Na2CO3溶液或者NaOH溶液除去乙酸乙酯中的乙酸和乙醇 | |
| C. | 天然油脂是混合物,主要成分是饱和和不饱和的高级脂肪酸 | |
| D. | 蛋白质溶液中加入Na2SO4可使其析出,再加水蛋白质又会重新溶解 |
17.已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
Na2O2(s)+CO2(g)═Na2CO3(s)+21O2(g)△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
Na2O2(s)+CO2(g)═Na2CO3(s)+21O2(g)△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
| A. | CO的燃烧热为283kJ | |
| B. | 25℃、101 kPa时,1 mol CO和2 mol CO的燃烧热相等 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H<-452 kJ/mol | |
| D. | CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 |
14.在某温度时,测得纯水中的c(H+)=2.0×10-7mol•L-1,则c(OH-)为( )
| A. | 2.0×10-7mol•L-1 | B. | 0.1×10-7mol•L-1 | C. | 5.0×10-6mol•L-1 | D. | 无法确定 |
15.下列生活中的化学小实验不合理的是( )
| A. | 用84消毒液除去地砖上的有色物质 | |
| B. | 用米汤检验加碘盐中的碘酸钾(KIO3) | |
| C. | 用纯碱(Na2CO3)溶液洗涤沾有油污的器具 | |
| D. | 利用燃烧的方法鉴别蚕丝和棉花 |
 “低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:


