题目内容
19.下列不存在丁达尔效应的分散系是( )| A. | 雾 | B. | 淀粉溶液 | C. | 食盐水 | D. | 氢氧化铁胶体 |
分析 根据胶体能够发生丁达尔现象,只要在选项中判断分散系是否是胶体即可作答.
解答 解:A.雾属于胶体,存在丁达尔效应,故A错误;
B.淀粉溶液为胶体,具有丁达尔效应,故B正确;
C.食盐水为溶液,不是胶体,不具有丁达尔效应,故C错误;
D.氢氧化铁胶体具有丁达尔效应,故D错误.
故选C.
点评 本题考查了胶体的性质,比较简单,只要准确掌握胶体性质即可作答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.V L浓度为1.000 mol•L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是( )
| A. | 向原溶液中通入常温常压下的HCl气体22.4V L,使其完全溶解 | |
| B. | 将溶液加热浓缩到0.5V L | |
| C. | 向原溶液中加入10.00 mol•L-1的盐酸0.2V L,再稀释至1.5V L | |
| D. | 向原溶液中加入V L 3 mol•L-1的盐酸混合均匀 |
10.下列物质的电子式书写正确的是( )
| A. |  | B. |  | C. | Cl:Cl | D. | Na+[F]- |
14.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L二氯甲烷的分子数约为NA个 | |
| B. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol | |
| C. | 17.6g丙烷中所含的极性共价键为4NA个 | |
| D. | 1molFeI2与足量氯气反应时转移的电子数为2NA |
4.(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
①某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背能量最低原理,B元素位于周期表五个区域中的s区.
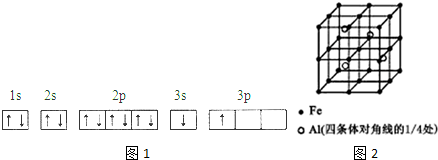
②ACl2分子中A的杂化类型为sp,ACl2的空间构型为直线形.
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物.
①以体心立方堆积形成的金属铁中,其原子的配位数为8.
②写出一种与CN-互为等电子体的单质的电子式 .
.
③六氰合亚铁离子[Fe(CN)6]4-中不存在B.
A.共价键 B.非极性键 C.配位键 D.σ键 E.π键
(3)一种Al-Fe合金的立体晶胞如图2所示.请据此回答下列问题:
①确定该合金的化学式Fe2Al.
②若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为$\root{3}{\frac{139}{2ρ{N}_{A}}}$cm.
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15399 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |

②ACl2分子中A的杂化类型为sp,ACl2的空间构型为直线形.
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物.
①以体心立方堆积形成的金属铁中,其原子的配位数为8.
②写出一种与CN-互为等电子体的单质的电子式
 .
.③六氰合亚铁离子[Fe(CN)6]4-中不存在B.
A.共价键 B.非极性键 C.配位键 D.σ键 E.π键
(3)一种Al-Fe合金的立体晶胞如图2所示.请据此回答下列问题:
①确定该合金的化学式Fe2Al.
②若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为$\root{3}{\frac{139}{2ρ{N}_{A}}}$cm.
9.下列有关用水杨酸和乙酸酐制备阿司匹林(乙酰水杨酸)的说法中正确的是( )
| A. | 为控制水浴温度为85~90℃,把温度计插入反应液中 | |
| B. | 为除去阿司匹林中混有的杂质,可在粗产品中加足量NaHCO3溶液、搅拌、过滤、洗涤沉淀,干燥即得精品 | |
| C. | 一定条件下,1mol阿司匹林最多可与2mol的NaOH反应 | |
| D. | 可用FeCl3溶液检验阿司匹林中是否含有未反应完的水杨酸 |

 .
.
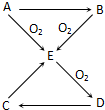 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),