题目内容
9.V L浓度为1.000 mol•L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是( )| A. | 向原溶液中通入常温常压下的HCl气体22.4V L,使其完全溶解 | |
| B. | 将溶液加热浓缩到0.5V L | |
| C. | 向原溶液中加入10.00 mol•L-1的盐酸0.2V L,再稀释至1.5V L | |
| D. | 向原溶液中加入V L 3 mol•L-1的盐酸混合均匀 |
分析 A.通入氯化氢气体后,溶液体积发生变化,无法计算所得溶液浓度;
B.氯化氢具有挥发性,加热过程中氯化氢挥发,导致所得溶液浓度减小;
C.计算出混合液中氯化氢的物质的量,然后根据c=$\frac{n}{V}$计算出所得溶液浓度;
D.两溶液混合后,混合液体积会发生变化,溶液的体积不是直接加和.
解答 解:A.标准状况下的HCl气体22.4VL,物质的量是:$\frac{22.4VL}{22.4L/mol}$=Vmol,VL浓度为1mol/L的盐酸中HCl的物质的量为:1mol/L×VL=Vmol,但无法计算通入氯化氢后溶液的体积,则无法计算所得溶液浓度,故A错误;
B.加热浓缩盐酸时,盐酸挥发,溶质的物质的量偏小,故B错误;
C.VL浓度为1mol/L的盐酸的物质的量是:1mol/L×VL=Vmol,10mol/L的盐酸0.2VL的物质的量是:10mol/L×0.2VL=2Vmol,再稀释至1.5VL,所得溶液浓度为:c(HCl)=$\frac{3Vmol}{1.5VL}$=2mol/L,故C正确;
D.浓稀盐酸混合后,溶液的体积不是直接加和,所以混合后溶液的物质的量浓度不是原来的2倍,故D错误;
故选C.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意HCl易挥发,为易错点,试题有利于培养学生的分析能力及化学计算能力.

练习册系列答案
相关题目
20.下列第四周期的元素中,最外层电子排布式不是4s1的元素是( )
| A. | 钾 | B. | 钙 | C. | 铬 | D. | 铜 |
14.下列说法正确的是( )
| A. | 有单质生成的反应一定是氧化还原反应 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| C. | 反应前后有元素化合价变化的反应一定是氧化还原反应 | |
| D. | 金属阳离子被还原一定得到金属单质 |
1.我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流.电池总反应为4Al+3O2+6H2O=4Al(OH)3,下列说法错误的是( )
| A. | 负极是铝失电子被氧化 | |
| B. | 电池工作时,电流由铝电极沿导线流向铂电极 | |
| C. | 以网状的铂为正极,可增大与氧气的接触面积 | |
| D. | 该电池通常只需更换铝板就可继续使用 |
18.下列离子方程式书写正确的是( )
| A. | 铜粉加入氯化铁溶液中:Cu+Fe3+═Cu2++Fe2+ | |
| B. | 金属钠投到水中:Na+H2O═Na++OH-+H2↑ | |
| C. | 氢氧化钠溶液加入到稀硫酸中:OH-+H+═H2O | |
| D. | 石灰石投入到稀盐酸中:CO32-+2H+═CO2↑+H2O |
19.下列不存在丁达尔效应的分散系是( )
| A. | 雾 | B. | 淀粉溶液 | C. | 食盐水 | D. | 氢氧化铁胶体 |
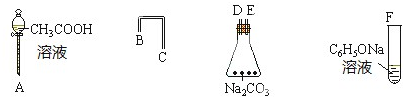

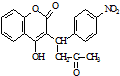
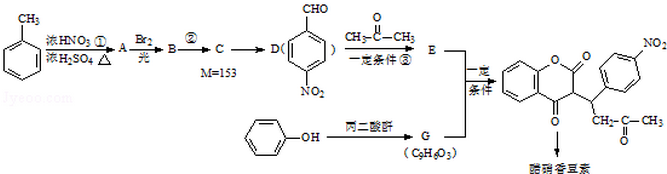 已知:R1-CHO
已知:R1-CHO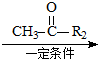 R1-CH=
R1-CH= +H2O
+H2O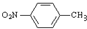 ;反应②的反应类型取代反应.
;反应②的反应类型取代反应.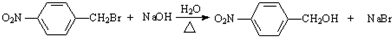 .
.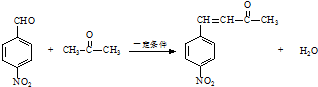 .
.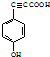 .
.