题目内容
11.设NA为阿伏加德罗常数值,下列有关叙述正确的是( )| A. | 高温、高压、催化剂条件下,足量N2与3 mol H2充分反应,共断裂H-H键3NA | |
| B. | 46 g Na与0.5 L 2 mol•L-1盐酸充分反应,转移电子数为2NA | |
| C. | 8.4 g固体NaHCO3中,含有阳离子0.2NA | |
| D. | 标准状况下,2.24 L CCl4含有的共价键数为0.4NA |
分析 A、合成氨的反应为可逆反应;
B、求出钠的物质的量,然后根据钠反应后变为+1价来分析;
C、求出碳酸氢钠的物质的量,然后根据碳酸氢钠由钠离子和碳酸氢根构成来分析;
D、标况下四氯化碳为液体.
解答 解:A、合成氨的反应为可逆反应,故不能进行彻底,则断裂的H-H键小于3NA条,故A错误;
B、46g钠的物质的量为2mol,和盐酸溶液反应时,先和盐酸反应,若盐酸不足则再和水反应,故金属钠能反应完,而钠反应后变为+1价,故2mol钠转移2NA个电子,故B正确;
C、8.4g碳酸氢钠的物质的量为0.1mol,而碳酸氢钠由钠离子和碳酸氢根构成,故0.1mol碳酸氢钠中含0.1NA个阳离子,故C错误;
D、标况下四氯化碳为液体,故不能根据气体摩尔体积来计算其物质的量,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
18.X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如表所示:
请回答下列问题:
(1)W位于周期表中第三周期,第ⅦA族;
(2)X可形成双原子分子,其分子的电子式是 ;Y和氢元素形成的10电子微粒中常见+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式HS-+H2O?H2S+OH-.
;Y和氢元素形成的10电子微粒中常见+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式HS-+H2O?H2S+OH-.
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式2S2Cl2+2H2O═3S↓+SO2↑+4HCl.
(4)将0.20molZY2和0.10molO2充入一个固定容积为5L的密闭容器中,在一定温度并有催化剂存在下,进行反应,经半分钟达到平衡,测得溶液中含YZ30.18mol,则v(O2)=0.036mol/(L•min);若温度不变,继续通入0.20molYZ2和0.10molO2,则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.36mol<n(YZ3)<0.40mol.
| X | Y | |
| Z | W |
(1)W位于周期表中第三周期,第ⅦA族;
(2)X可形成双原子分子,其分子的电子式是
 ;Y和氢元素形成的10电子微粒中常见+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式HS-+H2O?H2S+OH-.
;Y和氢元素形成的10电子微粒中常见+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式HS-+H2O?H2S+OH-.(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式2S2Cl2+2H2O═3S↓+SO2↑+4HCl.
(4)将0.20molZY2和0.10molO2充入一个固定容积为5L的密闭容器中,在一定温度并有催化剂存在下,进行反应,经半分钟达到平衡,测得溶液中含YZ30.18mol,则v(O2)=0.036mol/(L•min);若温度不变,继续通入0.20molYZ2和0.10molO2,则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.36mol<n(YZ3)<0.40mol.
19.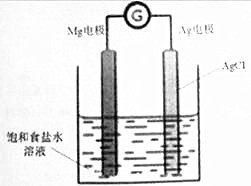 Mg/AgCl电池是一种化学电源,以镁和表面镀氯化银的银为电极,饱和食盐水为电解液,如图所示,发生的反应方程式为Mg+2AgCl=MgCl2+2Ag,下列说法正确的是( )
Mg/AgCl电池是一种化学电源,以镁和表面镀氯化银的银为电极,饱和食盐水为电解液,如图所示,发生的反应方程式为Mg+2AgCl=MgCl2+2Ag,下列说法正确的是( )
 Mg/AgCl电池是一种化学电源,以镁和表面镀氯化银的银为电极,饱和食盐水为电解液,如图所示,发生的反应方程式为Mg+2AgCl=MgCl2+2Ag,下列说法正确的是( )
Mg/AgCl电池是一种化学电源,以镁和表面镀氯化银的银为电极,饱和食盐水为电解液,如图所示,发生的反应方程式为Mg+2AgCl=MgCl2+2Ag,下列说法正确的是( )| A. | 镁电极上发生还原反应 | |
| B. | 银电极的电极反应式:AgCl+e-=Ag+Cl- | |
| C. | 该装置中能最转化方式为电能转化为化学能 | |
| D. | 电池工作时,钠离子移向镁电极,氯离子移向银电极 |
6.下列叙述中能判断某化学平衡一定发生移动的是( )
| A. | 平衡体系中各组分的浓度发生改变 | B. | 平衡体系中气体密度发生改变 | ||
| C. | 正、逆反应速率不相等了 | D. | 平衡体系中气体压强发生改变 |
16.下列叙述正确的是( )
| A. | 标准状况下,1mol H2O的体积约为22.4 L | |
| B. | 1 mol气体的体积若是22.4 L,它必定处于标准状况 | |
| C. | 20℃、101 kPa时1mol HCl所占的体积约为22.4 L | |
| D. | 标准状况下,1 mol H2和O2的混合气体的体积约为22.4 L |
3.下列有关物质应用的说法不正确的是( )
| A. | 漂白粉可用于养殖业消毒杀菌 | B. | SiO2可用于制光导纤维 | ||
| C. | FeCl3溶液可用于蚀刻铜制线路板 | D. | AlCl3可用于电解冶炼铝 |
