题目内容
6.下列有关电化学装置完全正确的是( )| A | B | C | D |
 |  |  |  |
| 铁上镀银 | 电解法制钠 | 保护铁 | 铜锌原电池 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Fe为阳极失去电子;
B.石墨为阳极,铁为阴极,电解食盐水生成NaOH、氢气、氯气;
C.Zn为负极,Fe为正极;
D.左侧烧杯中Zn与硫酸铜反应,不能构成原电池.
解答 解:A.铁上镀银,铁作阴极,银作阳极,电解质溶液为硝酸银溶液,故A错误;
B.工业上得到金属钠,电解熔融状态的氯化钠,电解氯化钠溶液得到NaOH、H2和Cl2,故B错误;
C.锌比铁活泼,锌作负极,铁作正极,这叫牺牲阳极的阴极保护法,故C正确;
D.若构成原电池,铜极烧杯中盛放硫酸铜溶液,锌极烧杯中盛放硫酸锌,故D错误;
故选C.
点评 本题考查电解原理的应用、金属腐蚀防护、原电池设计等,为高频考点,把握装置的判断、电极反应为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.

练习册系列答案
相关题目
16.下列溶液中物质的量浓度为1mol•L-1的是( )
| A. | 将40g NaOH溶解于1L水中 | |
| B. | 将22.4L氯化氢气体溶于水配成1L溶液 | |
| C. | 从100mL 10mol•L-1的浓盐酸中取出10mL | |
| D. | 20g NaOH溶解在水中配成500mL溶液 |
17. 研究硫元素及其化合物的性质具有重要意义.
研究硫元素及其化合物的性质具有重要意义.
(1)①硫离子的结构示意图为 .
.
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
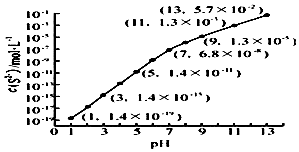
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如右图(忽略溶液体积的变化、H2S的挥发).
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=5时,Mn2+开始沉淀.1已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如表.
足量NaHSO3溶液与NaHCO3溶液反应的离子方程式为2HSO3-+CO32-=2SO32-+CO2↑+H2O.
 研究硫元素及其化合物的性质具有重要意义.
研究硫元素及其化合物的性质具有重要意义.(1)①硫离子的结构示意图为
 .
.②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如右图(忽略溶液体积的变化、H2S的挥发).
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
(3)25℃,两种酸的电离平衡常数如表.
足量NaHSO3溶液与NaHCO3溶液反应的离子方程式为2HSO3-+CO32-=2SO32-+CO2↑+H2O.
14.已知硅酸盐中,通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.Si2O44-四面体可用图(a)表示.图(b)是一种无限长单链结构的多硅酸根,其化学式为( )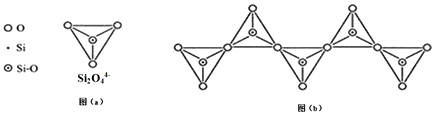

| A. | Si2O76- | B. | Si2O52- | C. | SiO32- | D. | Si4O116- |
1.如表是元素周期表的一部分,有关说法中正确的是( )
①a、b、e、f四种元素的原子半径:e>f>b>a
②h、i两种元素阴离子的还原性:h>i
③a、g两种元素的氢化物的稳定性:a>g
④d、e、f三种元素的最高价氧化物对应的水化物碱性依次增强
⑤九种元素中d元素的单质还原性最强.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VⅡA | |
| 二 | a | b | c | ||||
| 三 | d | e | f | g | h | i |
②h、i两种元素阴离子的还原性:h>i
③a、g两种元素的氢化物的稳定性:a>g
④d、e、f三种元素的最高价氧化物对应的水化物碱性依次增强
⑤九种元素中d元素的单质还原性最强.
| A. | ①③④ | B. | ②③⑤ | C. | ②④⑤ | D. | ①③⑤ |
11.已知A2-离子共含有x个中子,A元素的质量数为m,则n克A2-离子共含有电子的物质的量为( )
| A. | $\frac{n(m-x)}{m}$ | B. | $\frac{n(m-x+2)}{m}$ | C. | $\frac{m-x+2}{m-x}$ | D. | $\frac{n(m-x-2)}{m}$ |
18.X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如表所示:
请回答下列问题:
(1)W位于周期表中第三周期,第ⅦA族;
(2)X可形成双原子分子,其分子的电子式是 ;Y和氢元素形成的10电子微粒中常见+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式HS-+H2O?H2S+OH-.
;Y和氢元素形成的10电子微粒中常见+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式HS-+H2O?H2S+OH-.
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式2S2Cl2+2H2O═3S↓+SO2↑+4HCl.
(4)将0.20molZY2和0.10molO2充入一个固定容积为5L的密闭容器中,在一定温度并有催化剂存在下,进行反应,经半分钟达到平衡,测得溶液中含YZ30.18mol,则v(O2)=0.036mol/(L•min);若温度不变,继续通入0.20molYZ2和0.10molO2,则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.36mol<n(YZ3)<0.40mol.
| X | Y | |
| Z | W |
(1)W位于周期表中第三周期,第ⅦA族;
(2)X可形成双原子分子,其分子的电子式是
 ;Y和氢元素形成的10电子微粒中常见+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式HS-+H2O?H2S+OH-.
;Y和氢元素形成的10电子微粒中常见+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式HS-+H2O?H2S+OH-.(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式2S2Cl2+2H2O═3S↓+SO2↑+4HCl.
(4)将0.20molZY2和0.10molO2充入一个固定容积为5L的密闭容器中,在一定温度并有催化剂存在下,进行反应,经半分钟达到平衡,测得溶液中含YZ30.18mol,则v(O2)=0.036mol/(L•min);若温度不变,继续通入0.20molYZ2和0.10molO2,则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.36mol<n(YZ3)<0.40mol.
15.下列对主要实验现象描述和结论的判断都正确的是( )
| 选项 | 实验操作 | 主要现象 | 结论 |
| A | 将在酒精灯灼烧后的铜丝迅速插入无水乙醇中 | 铜丝变黑 | CH3CH2OH发生氧化反应生成CH3COOH,铜丝起催化作用 |
| B | 分别在苯和乙醇中滴加酸性高锰酸钾溶液 | 紫红色都褪去 | 苯和乙醇都有还原性 |
| C | 分别在水、乙醇中 加入钠粒 | 都产生气体 | 产生的气体为氢气 |
| D | 将酒精在空气中点燃 | 产生无色火焰 | 酒精发生氧化反应 |
| A. | A | B. | B | C. | C | D. | D |
19.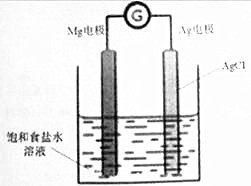 Mg/AgCl电池是一种化学电源,以镁和表面镀氯化银的银为电极,饱和食盐水为电解液,如图所示,发生的反应方程式为Mg+2AgCl=MgCl2+2Ag,下列说法正确的是( )
Mg/AgCl电池是一种化学电源,以镁和表面镀氯化银的银为电极,饱和食盐水为电解液,如图所示,发生的反应方程式为Mg+2AgCl=MgCl2+2Ag,下列说法正确的是( )
 Mg/AgCl电池是一种化学电源,以镁和表面镀氯化银的银为电极,饱和食盐水为电解液,如图所示,发生的反应方程式为Mg+2AgCl=MgCl2+2Ag,下列说法正确的是( )
Mg/AgCl电池是一种化学电源,以镁和表面镀氯化银的银为电极,饱和食盐水为电解液,如图所示,发生的反应方程式为Mg+2AgCl=MgCl2+2Ag,下列说法正确的是( )| A. | 镁电极上发生还原反应 | |
| B. | 银电极的电极反应式:AgCl+e-=Ag+Cl- | |
| C. | 该装置中能最转化方式为电能转化为化学能 | |
| D. | 电池工作时,钠离子移向镁电极,氯离子移向银电极 |