题目内容
19.据下表信息,判断以下叙述正确的是( )部分短周期元素的原子半径及主要化合价
| 元素代号 | G | L | M | Q | R | T |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.075 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +6,-2 | +5,-3 | -2 |
| A. | GOH溶液和M(OH)3可以相互反应 | B. | 非金属性:T<Q | ||
| C. | 气态氢化物的稳定性:R>T | D. | L2+与T2-核外电子数相等 |
分析 短周期元素,由元素的化合价可知,T只有-2价,则T为O元素;T和Q的最低化合价相同,应位于相同主族,且Q原子半径较大,可知Q为S元素;R有+5、-3价,处于ⅤA族,原子半径小于S,故R为N元素;G、L、M的化合价分别为+1、+2、+3,原子半径依次减小,均大于S原子半径,应处于第三周期,可推知G、L、M元素则分别为Na、Mg、Al,结合元素单质化合物的性质以及元素周期律解答.
解答 解:短周期元素,由元素的化合价可知,T只有-2价,则T为O元素;T和Q的最低化合价相同,应位于相同主族,且Q原子半径较大,可知Q为S元素;R有+5、-3价,处于ⅤA族,原子半径小于S,故R为N元素;G、L、M的化合价分别为+1、+2、+3,原子半径依次减小,均大于S原子半径,应处于第三周期,可推知G、L、M元素则分别为Na、Mg、Al,
A.NaOH溶液和Al(OH)3可以相互反应生成偏铝酸钠与水,故A正确;
B.同主族自上而下非金属性减弱,O的非金属性强于S元素,故B错误;
C.O的非金属性强于N元素,所以对应的氢化物稳定性较稳定,故C错误;
D.Mg2+与O2-离子核外电子数都是10,故D正确,
故选AD.
点评 本题考查元素周期表和元素周期律的基础知识,利用原子半径及化合价来推断出元素是解答本题的关键,难度不大.

练习册系列答案
相关题目
9.关于周期表和周期律,下列说法中正确的是( )
| A. | 在周期表中,元素的族序数都等于其原子的最外层电子数 | |
| B. | ⅦA族元素的单质,随分子量的增大,熔、沸点升高;ⅠA族单质,随分子量的增大,熔、沸点下降 | |
| C. | 周期表中非金属性最强的元素,其最高价氧化物的水化物酸性也最强 | |
| D. | 同主族元素随原子核电荷数的递增,原子半径依次增大 |
7.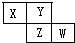 X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
 X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )| A. | Z元素的氧化物对应的水化物是强酸 | |
| B. | 含有X、Y、Z的化合物一定是共价化合物 | |
| C. | X的气态氢化物与W的气态氢化物反应的生成物中一定含有离子 | |
| D. | 原子半径大小顺序:X>Y>Z>W |
14.设NA为阿伏伽德常数的数值,下列说法正确的是( )
| A. | 18 g H2O含有10NA个质子 | |
| B. | 25℃时,PH=13的NaOH溶液中含有的OH- 数目为0.1NA | |
| C. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| D. | 56 g铁片投入足量浓H2SO4中生成NA个SO2分子 |
4.为提纯下列物质(括号内为杂质),所选用的试剂和分离方法均正确的是( )
| 选项 | 物质 | 除杂试剂 | 分离方法 |
| A | 乙醇 (乙酸) | NaOH溶液 | 蒸馏 |
| B | 甲烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
| C | 苯(苯酚) | 浓溴水 | 过滤 |
| D | 溴乙烷(溴) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
8.m mol C2H2跟n mol H2在密闭容器中反应,当该可逆反应达到平衡时,生成p mol C2H4.将反应后的混合气体完全燃烧生成CO2和H2O,所需要氧气的物质的量是( )
| A. | (3m+n)mol | B. | ($\frac{5}{2}$m+$\frac{n}{2}$-3p)mol | C. | (3m+n+2p)mol | D. | ($\frac{5}{2}$m+$\frac{n}{2}$)mol |
 )的路线流程图.路线流程图示例如图:
)的路线流程图.路线流程图示例如图: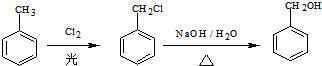
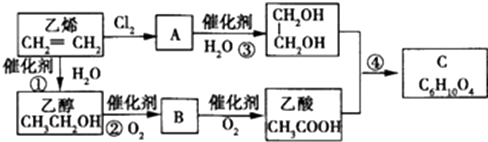
 .
. 某同学利用如图装置来验证同主族元素非金属性的变化规律.
某同学利用如图装置来验证同主族元素非金属性的变化规律.