题目内容
1.四种易溶于水的强电解质A、B、C、D由以下7种离子组成(电解质中阴离子各不相同).| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
①A、C溶液显碱性,A、B的溶液中水的电离程度相同;
②C和D的溶液混合反应的现象只是有白色沉淀生成,B和C的溶液混合反应的现象只是有刺激性气味的气体生成,A和D的溶液混合无明显现象.
(1)A是CH3COONa,B是NH4Cl.
(2)写出C与D的溶液反应的离子方程式Ba2++SO42-=BaSO4↓.
分析 由②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,则C为碱,且C含钡离子,D中含硫酸根离子,B中含铵根离子;
又①A、C溶液的pH均大于7,则说明C为Ba(OH)2,A为CH3COONa;
且A、B的溶液中水的电离程度相同,A溶液和D溶液混合时无明显现象,A、D均为钠盐,A、B溶液的水解程度相同,则D为Na2SO4,则B为NH4Cl,以此解答该题.
解答 解:由②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,则C为碱,且C含钡离子,D中含硫酸根离子,B中含铵根离子;
又①A、C溶液的pH均大于7,则说明C为Ba(OH)2,A为CH3COONa;
且A、B的溶液中水的电离程度相同,A溶液和D溶液混合时无明显现象,A、D均为钠盐,A、B溶液的水解程度相同,则D为Na2SO4,则B为NH4Cl,
(1)由上述分析可知:A为CH3COONa,B为NH4Cl,故答案为:CH3COONa;NH4Cl;
(2)C与D的溶液反应是Ba(OH)2和Na2SO4反应生成硫酸钡沉淀的过程,反应的离子方程式为:Ba2++SO42-=BaSO4↓,故答案为:Ba2++SO42-=BaSO4↓.
点评 本题考查无机物的推断,为高频考点,把握离子之间反应、元素化合物知识等为解答的关键,侧重分析与推断能力的考查,注意C为氢氧化钡为推断的突破口,题目难度不大.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
5.下列有机物包含有两个手性碳原子的是( )
| A. | 乳酸CH3-CHOH-COOH | |
| B. | 甘油 CH2OH-CHOH-CH2OH | |
| C. | 脱氧核糖 CH2OH-CHOH-CHOH-CH2-CHO | |
| D. | 核糖 CH2OH-CHOH-CHOH-CHOH-CHO |
9.关于周期表和周期律,下列说法中正确的是( )
| A. | 在周期表中,元素的族序数都等于其原子的最外层电子数 | |
| B. | ⅦA族元素的单质,随分子量的增大,熔、沸点升高;ⅠA族单质,随分子量的增大,熔、沸点下降 | |
| C. | 周期表中非金属性最强的元素,其最高价氧化物的水化物酸性也最强 | |
| D. | 同主族元素随原子核电荷数的递增,原子半径依次增大 |
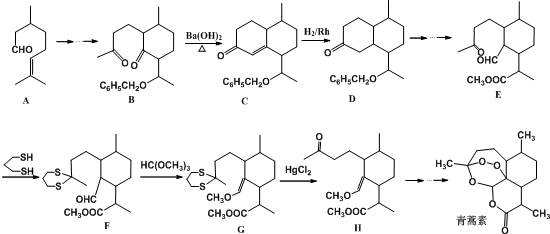
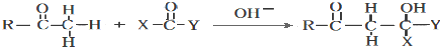
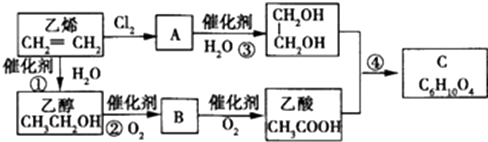
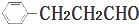 )的路线流程图.路线流程图示例如图:
)的路线流程图.路线流程图示例如图: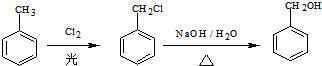
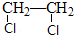 .
.