题目内容
18.(1)写出CO2的结构式O=C=O,属于分子晶体(2)写出NaOH的电子式
 ,含有的化学键离子键、极性键.
,含有的化学键离子键、极性键.
分析 (1)二氧化碳是直线形结构,每个氧原子和碳原子形成碳氧双键,靠分子间作用力结合,形成分子晶体;
(2)氢氧化钠为离子化合物,含有离子键和极性键.
解答 解:(1)二氧化碳是直线形结构,每个氧原子和碳原子形成碳氧双键,其结构式为O=C=O,靠分子间作用力结合,形成分子晶体,
故答案为:O=C=O;分子;
(2)氢氧化钠为离子化合物,电子式为 ,含有离子键和极性键,
,含有离子键和极性键,
故答案为: ;离子键、极性键.
;离子键、极性键.
点评 本题考查化学用语和化学键、晶体类型、化合物电子式书写,为高频考点,难度不大,掌握电子式、结构式、化学键类型是解题关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.关于周期表和周期律,下列说法中正确的是( )
| A. | 在周期表中,元素的族序数都等于其原子的最外层电子数 | |
| B. | ⅦA族元素的单质,随分子量的增大,熔、沸点升高;ⅠA族单质,随分子量的增大,熔、沸点下降 | |
| C. | 周期表中非金属性最强的元素,其最高价氧化物的水化物酸性也最强 | |
| D. | 同主族元素随原子核电荷数的递增,原子半径依次增大 |
7.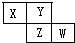 X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
 X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
X、Y、Z、W四种短周期元素在周期表的位置如图,Y原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )| A. | Z元素的氧化物对应的水化物是强酸 | |
| B. | 含有X、Y、Z的化合物一定是共价化合物 | |
| C. | X的气态氢化物与W的气态氢化物反应的生成物中一定含有离子 | |
| D. | 原子半径大小顺序:X>Y>Z>W |
8.m mol C2H2跟n mol H2在密闭容器中反应,当该可逆反应达到平衡时,生成p mol C2H4.将反应后的混合气体完全燃烧生成CO2和H2O,所需要氧气的物质的量是( )
| A. | (3m+n)mol | B. | ($\frac{5}{2}$m+$\frac{n}{2}$-3p)mol | C. | (3m+n+2p)mol | D. | ($\frac{5}{2}$m+$\frac{n}{2}$)mol |
 ;
;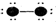
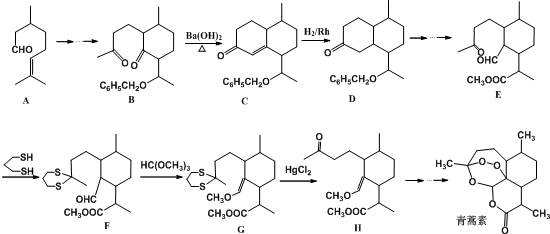
 )的路线流程图.路线流程图示例如图:
)的路线流程图.路线流程图示例如图: