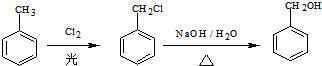
题目内容
5.根据原子结构及元素周期律的知识,下列叙述正确的是( )| A. | 由于分子中氢原子数:H2SO4>HClO4,故酸性:H2SO4>HClO4 | |
| B. | 硅处于金属与非金属的过渡位置,硅可用作半导体材料 | |
| C. | 由于氮元素的最低化合价只有-3价,故NH5这种物质不可能存在 | |
| D. | Cl-、S2-、Ca2+、K+半径逐渐减小 |
分析 A、非金属性Cl>S,对应最高价氧化物的水化物的酸性为HClO4>H2SO4;
B、处于金属与非金属交界处的元素表现一定的金属性、非金属性;
C、可以存在离子化合物NH4H;
D、电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大.
解答 解:A.非金属性Cl>S,对应最高价氧化物的水化物的酸性为HClO4>H2SO4,与氢原子数无关,故A错误;
B.Si处于金属与非金属交界处,表现一定的金属性、非金属性,可用作半导体材料,故B正确;
C.可以存在离子化合物NH4H,化学式为NH5,故C错误;
D.电子层结构相同,核电荷数越大离子半径越小,故离子半径:S2->Cl->K+>Ca2+,故D错误,
故选B.
点评 本题考查酸性强弱、元素周期表、微粒半径比较等,难度不大,注意理解掌握微粒半径比较.

练习册系列答案
相关题目
9.下列物质是纯净物的是( )
| A. | 盐酸 | B. | 冰醋酸 | C. | 漂白粉 | D. | 淀粉 |
20.某无色溶液中含有大量的H+和SO42-,则此溶液还能大量存在的离子组是( )
| A. | Na+、Fe2+、NO3- | B. | Na+、Mg2+、NO3- | C. | Cu2+、Ba2+、Cl- | D. | K+、Na+、HCO3- |
17.某一有机物A可发生下列反应: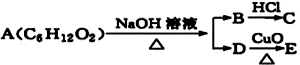 ,已知C能与NaHCO3反应产生气体,且C、E均不发生银镜反应,则A的可能结构有( )
,已知C能与NaHCO3反应产生气体,且C、E均不发生银镜反应,则A的可能结构有( )
 ,已知C能与NaHCO3反应产生气体,且C、E均不发生银镜反应,则A的可能结构有( )
,已知C能与NaHCO3反应产生气体,且C、E均不发生银镜反应,则A的可能结构有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
14.设NA为阿伏伽德常数的数值,下列说法正确的是( )
| A. | 18 g H2O含有10NA个质子 | |
| B. | 25℃时,PH=13的NaOH溶液中含有的OH- 数目为0.1NA | |
| C. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| D. | 56 g铁片投入足量浓H2SO4中生成NA个SO2分子 |
15.进行化学实验、观察实验现象,通过分析、推理得出正确的结论是化学学习的方法之一.下列对有关实验事实的解释正确的是( )
| A. | 将N2和过量的O2在高温或放电的条件下反应得到红棕色的气体,说明NO为红棕色气体 | |
| B. | 在AgNO3溶液中加入锌粉,能置换出银,说明Ag+的还原性比Zn2+强 | |
| C. | 用干净的铂丝蘸取少量溶液在酒精灯外焰上灼烧,发现火焰呈黄色,则溶液中一定不含K+ | |
| D. | 浓硫酸放入蔗糖中,能使蔗糖炭化,说明浓硫酸具有脱水性 |
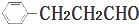 )的路线流程图.路线流程图示例如图:
)的路线流程图.路线流程图示例如图: