题目内容
下列热化学方程式,正确的是( )
| A、甲烷的标准燃烧热为-890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ?mol-1 |
| B、500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放出的热量为 19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ?mol-1 |
| C、S(s)+O2(g)═SO2(g)△H=-296.8 kJ?mol-1(反应热) |
| D、2NO2═O2+2NO△H=+116.2 kJ?mol-1(反应热) |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、据燃烧热的概念分析,注意H生成的是否是液态水;
B、合成氨是可逆反应,反应物不能完全转化;
C、符合热化学方程式书写规则;
D、没有标明物质的状态.
B、合成氨是可逆反应,反应物不能完全转化;
C、符合热化学方程式书写规则;
D、没有标明物质的状态.
解答:
解:A、甲烷的标准燃烧热为-890.3kJ?mol-1,表示1mol甲烷完全燃烧生成二氧化碳与液态水放出热量为890.3kJ,甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890.3kJ?mol-1,故A错误;
B、合成氨是可逆反应,反应物不能完全转化,0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,生成2mol氨气放出的热量大于38.6kJ,故B错误;
C、符合热化学方程式的书写规则,故C正确;
D、热化学方程式没有注明各物质状态,故D错误;
故选C.
B、合成氨是可逆反应,反应物不能完全转化,0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,生成2mol氨气放出的热量大于38.6kJ,故B错误;
C、符合热化学方程式的书写规则,故C正确;
D、热化学方程式没有注明各物质状态,故D错误;
故选C.
点评:本题考查了燃烧热的概念、可逆反应的焓变、热化学方程式书写,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有机物结构中,核磁共振氢谱不可能只有一个峰值的是( )
| A、C3H4 |
| B、C3H6 |
| C、C3H8 |
| D、C5H12 |
在5KCl+KClO3+3H2SO4═3Cl2↑+3K2SO4+3H2O中,被氧化与被还原的氯原子的物质的量比为( )
| A、5:1 | B、1:5 |
| C、1:1 | D、3:1 |
某溶液中由水电离产生的c(H+)=1×10-10mol/L,该溶液的溶质不可能是( )
| A、KOH |
| B、KHSO4 |
| C、HCl |
| D、K2CO3 |
把0.05mol NaOH晶体分别加入到下列100mL液体中,溶液导电性变化较大的是( )
| A、0.5 mol?L-1 醋酸 |
| B、0.5 mol?L-1盐酸 |
| C、0.5 mol?L-1硫酸 |
| D、0.5 mol?L-1硝酸 |
下列有关说法正确的是( )
| A、C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
| B、常温下,反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0 |
| C、N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 |
| D、水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
下列溶液中的Cl-浓度与50mL 1.0mol?L-1 FeCl3溶液中的Cl-浓度相等的是( )
| A、100 mL 3.0 mol?L-1NaCl溶液 |
| B、75mL 1.0 mol?L-1CaCl2溶液 |
| C、150 mL 1.0mol?L-1KCl溶液 |
| D、100 mL 0.5 mol?L-1AlCl3溶液 |
设NA为阿伏加德罗常数,如果ag某气体含分子数为P,则bg该气体在标准状况下的体积V(L)是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
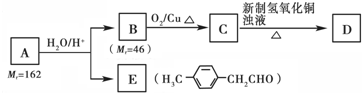
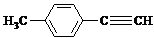 )的一条路线如下:
)的一条路线如下: