题目内容
17.“温室效应”是全球关注的环境问题之一.CO2是目前大气中含量最高的一种温室气体,CO2的综合利用是解决温室及能源问题的有效途径.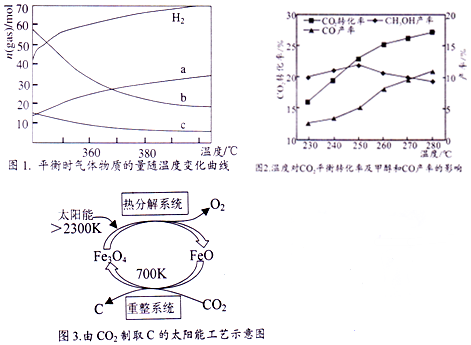
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH.己知部分反应的热化学方程式如下:
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(1)△H1=akJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H2=bkJ•mol-1
H2O(g)=H2O(l)△H3=ckJ•mol-1
则 CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=3b-a-ckJ•mol-1
(2)CO2催化加氢也能合成低碳烯烃:2CO2(g)+6H2(g)?C2H4(g)+4H2O (g),不同温度下平衡时的四种气态物质的物质的量如图1所示,曲线b表示的物质为H2O (写化学式).
(3)CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成CH3OH和CO.
反应 A:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
反应B:CO2(g)+H2(g)?CO(g)+H2O(g)
控制CO2和H2初始投料比为1:3时,温度对CO2平衡转化率及甲醇和CO产率的影响如图2所示.
①由图2可知温度升高CO的产率上升,其主要原因可能是反应B正反应是吸热反应,温度升高平衡正向移动,CO产率升高.
②由图2可知获取CH3OH最适宜的温度是250℃,下列措施有利于提高CO2转化为CH3OH的平衡转化率的措施有BD.
A.使用催化剂 B.增大体系压强
C.增大CO2和H2的初始投料比 D.投料比不变和容器体积不变,增加反应物的浓度
(4)在催化剂表面通过施加电压可将溶解在水中的二氧化碳直接转化为乙醇,则生成乙醇的电极反应式为2CO2+12H++12e-=C2H5OH+3H2O.
(5)由CO2制取C的太阳能工艺如图3所示.“热分解系统”发生的反应为:2Fe3O4$\frac{\underline{\;2300K\;}}{\;}$6FeO+O2↑,每分解1mol Fe3O4转移电子的物质的量为2mol;“重整系统”发生反应的化学方程式为6FeO(S)+CO2$\frac{\underline{\;700K\;}}{\;}$2Fe3O4(S)+C.
分析 已知①CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(1)△H1=akJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H2=bkJ•mol-1
③H2O(g)=H2O(l)△H3=ckJ•mol-1
根据盖斯定律知,③×2+①-③得:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);
(2)根据图知,升高温度,氢气物质的量增大,说明平衡逆向移动,则正反应是放热反应,a曲线随着温度升高,物质的量增大,为二氧化碳,b、c随着温度升高其物质的量降低,为生成物水、乙烯,但水的变化量大于乙烯,据此判断b曲线代表物质;
(3)①反应B正反应是吸热反应,温度升高平衡正向移动,CO产率升高;
(3)②据图示进行分析250℃甲醇转化率最高;由CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-8 可知提高CO2转化为CH3OH平衡转化率,应使平衡向正向移动,可降低温度,增大浓度;
(4)电解时,二氧化碳在b极上得电子发生还原反应生成乙醇;
(5)该反应中Fe元素化合价由+3价变为+2价,O元素化合价由-2价变为0价,根据转移电子和Fe3O4之间的关系式计算;根据图知,反应物是二氧化碳和FeO,生成物的四氧化三铁和C,反应条件是700K.
解答 解:已知①CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(1)△H1=akJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H2=bkJ•mol-1
③H2O(g)=H2O(l)△H3=ckJ•mol-1
根据盖斯定律知,②×3-①-③得:CO2(g)+3H2(g)?CH3OH(g)+H2O(g))△H=(3b-a-c)kJ•mol-1,
故答案为:3b-a-c;
(2)根据图知,升高温度,氢气物质的量增大,说明平衡逆向移动,则正反应是放热反应,a曲线随着温度升高,物质的量增大,为二氧化碳,b、c随着温度升高其物质的量降低,为生成物水、乙烯,但水的变化量大于乙烯,所以b曲线代表H2O,
故答案为:H2O;
(3)①由图2可知温度升高CO的产率上升,其主要原因可能是反应B正反应是吸热反应,温度升高平衡正向移动,CO产率升高,
故答案为:反应B正反应是吸热反应,温度升高平衡正向移动,CO产率升高;
(3)②据图示进行分析250℃甲醇转化率最高,故获取CH3OH最适宜的温度是250℃;
A.使用催化剂,平衡不移动,不能提高转化率,故A错误;
B、增大体系压强,平衡向正方向移动,提高甲醇转化率,故B正确;
C、增大CO2和H2的初始投料比,可增大氢气的转化率,二氧化碳的转化率减小,故C错误;
D、投料比不变,增加反应物的浓度,平衡正向移动,可增大转化率,故D正确;
故答案为:250℃;BD;
(4)电解时,二氧化碳在b极上得电子发生还原反应生成C2H5OH,电极反应式为2CO2+12H++12e-=C2H5OH+3H2O,
故答案为:2CO2+12H++12e-=C2H5OH+3H2O;
(5)该反应中Fe元素化合价由+3价变为+2价,O元素化合价由-2价变为0价,分解2mol四氧化三铁转移4mol电子,则分解1mol四氧化三铁转移2mol电子;根据图知,反应物是二氧化碳和FeO,生成物的四氧化三铁和C,反应条件是700K,反应方程式为6FeO(S)+CO2$\frac{\underline{\;700K\;}}{\;}$2Fe3O4(S)+C,
故答案为:2mol;6FeO(S)+CO2$\frac{\underline{\;700K\;}}{\;}$2Fe3O4(S)+C.
点评 本题考查影响平衡移动的因素、热化学方程式的书写、氧化还原反应有关计算,为高频考点,注意四氧化三铁中Fe元素化合价,难点是电极反应式的书写,题目难度不大.

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案| 分子式 | 结构简式 | 外观 | 熔点 | 溶解性 |
| C12H10ClN3O |  | 白色结晶粉末 | 170~172°C | 易溶于水 |
(2)氯吡苯脲的晶体类型为分子晶体.该分子是由极性、非极性键形成的极性分子(填“极性”或“非极性”)
 (1)溶液的pH除了可以通过实验得出的具体数据计算得到,在实验室中还可以用pH试纸或pH计来测量得到.
(1)溶液的pH除了可以通过实验得出的具体数据计算得到,在实验室中还可以用pH试纸或pH计来测量得到.(2)某研究性学习小组用pH=1的盐酸滴定25.00mL未知物质的量浓度的NaOH溶液,从而求出该NaOH溶液的pH值(选用酚酞作为指示剂)
①实验过程中需要使用的仪器有铁架台、滴定管夹、碱式滴定管、胶头滴管、酸式滴定管、锥形瓶
②如图,是某次滴定时的滴定管中的液面,其读数为22.60mL;
③如何判断滴定到达终点当滴加最后一滴盐酸,溶液的颜色由黄色变为橙色,且在半分钟内不变色
④根据下列数据:
| 滴定次数 | 待测液体积(mL)[来源 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
⑤在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有:BD.
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.酸式滴定管尖嘴部分有气泡,滴定后消失.
| A. | 不能和氢气反应 | B. | 属于不饱和烃 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 含有碳碳双键 |

 如图为原电池装置示意图:
如图为原电池装置示意图: