题目内容
9.(1)氢气是一种新型的绿色能源,又是一种重要的化工原料.①氢气燃烧热值高.实验测得,在常温常压下,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量.则表示H2燃烧热的热化学方程式是B
A.H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=+285.8kJ/mol
B.H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ/mol
C.H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=+285.8kJ/mol
D.H2+$\frac{1}{2}$O2═H2O△H=-285.8 kJ/mol
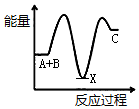
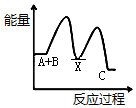
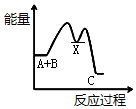
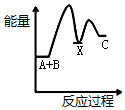
②氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol
反应达到平衡后,升高温度则反应速率增大(填“增大”或“减小”);平衡将向逆反应方向(填“正反应方向”或“逆反应方向”)移动.
(2)锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.电解质溶液是KOH溶液,电池总反应为Zn+Ag2O═ZnO+2Ag.该电池的负极材料是Zn;电池工作时,阳离子向正极(填“正极”或“负极”)移动;
(3)常温下,0.1mol/L NH4Cl溶液呈酸性(填“酸”、“碱”或“中”),升高温度可以促进(填“促进”或“抑制”)NH4Cl的水解.
分析 (1)①燃烧热是1mol可燃物完全燃烧生成温度氧化物时放出的热量以及物质的量与能量成正比;
②根据合成氨反应的热化学方程式如下:N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol为放热反应,所以升高温度则反应速率增大,平衡将向吸热反应方向移动;
(2)负极上失电子发生氧化反应;原电池中阳离子向正极移动;
(3)强酸强碱盐在溶液中不水解,溶液显中性,强酸弱碱盐在溶液中水解,溶液显酸性,升高温度促进盐的水解.
解答 解:(1)①在298K、101kPa时,2g 即1molH2完全燃烧生成液态水,放出285.8kJ热量,则表示氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,故选B,
故答案为:B;
②因为合成氨反应的热化学方程式如下:N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol为放热反应,所以升高温度则反应速率增大,平衡将向吸热反应方向即逆反应方向移动,
故答案为:增大;逆反应方向;
(2)负极上失电子发生氧化反应,根据电池总反应为Zn+Ag2O═ZnO+2Ag可知,Zn失电子为负极;原电池中阳离子向正极移动,
故答案为:Zn;正极;
(3)常温下,0.1mol/L NH4Cl溶液为强酸弱碱盐在溶液中水解,溶液显酸性;升高温度促进NH4Cl的水解,
故答案为:酸;促进.
点评 本题考查了热化学方程式书写,化学平衡移动原理,原电池的原理及其盐类水解等,比较综合,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.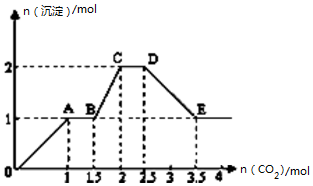 现有易溶强电解质的混合溶液10L,其中可能含存K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的是( )
现有易溶强电解质的混合溶液10L,其中可能含存K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的是( )
 现有易溶强电解质的混合溶液10L,其中可能含存K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的是( )
现有易溶强电解质的混合溶液10L,其中可能含存K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的是( )| A. | 该溶液中能确定存在的离子是 Ba2+、AlO2-、NH4+ | |
| B. | 肯定不存在的离子是SO42-、OH- | |
| C. | 若不能确定的离子中至少还存在一种阳离子,则该离子的最小浓度为0.2mol/L | |
| D. | OA 段反应的离子方程式:2 AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
14.化学与生产、生活、科技等密切相关,下列说法正确的是( )
| A. | 应研发新型高效催化剂以提高合成氨工业中氨的产率 | |
| B. | 糖尿病患者不能食用含糖类的物质 | |
| C. | 空气中NO和NO,等氮氧化物含量过高可导致光化学烟雾或酸雨的形成 | |
| D. | “84”消毒液与漂白粉溶液的有效成分均是Ca( ClO)2,均具有消毒杀菌能力 |
1.下列各组物质的性质比较中,不正确的是( )
| A. | 稳定性:NH3<PH3<SiH4 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 氧化性:F2>Cl2>Br2 |
18.酚酞是中学阶段常用的酸碱指示剂,己知其结构简式如图所示;下列关于酚酞的说法正确的是( )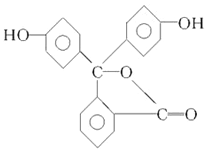

| A. | 酚酞分子中含有两种官能团 | |
| B. | 酚酞的分子式为C20H12O4 | |
| C. | 酚酞属于芳香烃 | |
| D. | 酚酞结构中含有羟基(-OH),故酚酞属于醇 |
19.下列操作或装置能达到实验目的是( )
| A. | 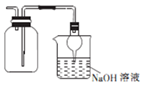 收集NO2并防止其污染环境 | |
| B. | 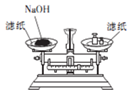 称取一定量的NaOH | |
| C. | 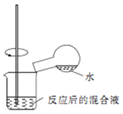 检验浓硫酸与铜反应后的产物中,是否含有铜离子 | |
| D. | 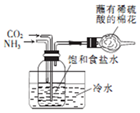 制取NaHCO3 |