题目内容
12.(1)1840年盖斯提出了盖斯定律:“不管化学反应是一步完成还是分数步完成,这个过程的热效应是相同的.”火箭发射时可用肼(N2H4)为燃料以及NO2 作氧化剂,这两者反应生成N2和水蒸气.已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7 kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534 kJ/mol.
写出肼与NO2反应的热化学方程式2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol.
(2)写出NH4HSO3的电离方程式NH4HSO3═NH4++HSO3-.
(3)氨在国民经济中占重要地位,在合成氨工业中,合成塔中每产生2mol氨,放出92.2kl热量,若起始时向容器中放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q<(填“<、>或=”) 184.4kJ;已知H-H键键能为436kJ/mol,N-H键键能为391kJ/mol,则N≡N键键能为945.8KJ/mol.
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式,反应的热化学方程式改变系数,焓变随之改变,通过热化学方程式之间的加减计算得到;
(2)NH4HSO3为弱酸亚硫酸的酸式盐,亚硫酸氢根离子不能拆;
(3)反应是可逆反应不能进行彻底,依据反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量计算.
解答 解:(1)①N2(g)+O2(g)=2NO2(g)△H1=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol
依据盖斯定律:②×2-①得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol;
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol;
(2)NH4HSO3是强电解质,在水中电离出铵根离子和亚硫酸氢根离子,NH4HSO3═NH4++HSO3-,
故答案为:NH4HSO3═NH4++HSO3-;
(3)反应是可逆反应不能进行彻底,该温度下合成塔中放入2mol N2和6mol H2,生成的氨气小于2mol,故达平衡后放出的热量小于184.4 kJ,3H2+N2?2NH3,反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量=3×436+N≡N键键能-6×391=-92.2,N≡N键键能=945.8KJ/mol;
故答案为:<;945.8KJ/mol.
点评 本题考查了化学能与热能关系分析判断、电离方程式的书写,注意盖斯定律的应用,为高频考点,题目难度中等.

练习册系列答案
相关题目
4.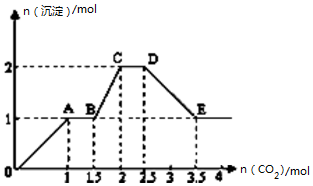 现有易溶强电解质的混合溶液10L,其中可能含存K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的是( )
现有易溶强电解质的混合溶液10L,其中可能含存K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的是( )
 现有易溶强电解质的混合溶液10L,其中可能含存K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的是( )
现有易溶强电解质的混合溶液10L,其中可能含存K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的是( )| A. | 该溶液中能确定存在的离子是 Ba2+、AlO2-、NH4+ | |
| B. | 肯定不存在的离子是SO42-、OH- | |
| C. | 若不能确定的离子中至少还存在一种阳离子,则该离子的最小浓度为0.2mol/L | |
| D. | OA 段反应的离子方程式:2 AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
1.下列各组物质的性质比较中,不正确的是( )
| A. | 稳定性:NH3<PH3<SiH4 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 氧化性:F2>Cl2>Br2 |
 某化学课外兴趣小组为探究铜与浓硫酸反应气体产物的性质,拟用如图所示的装置的组合进行实验.
某化学课外兴趣小组为探究铜与浓硫酸反应气体产物的性质,拟用如图所示的装置的组合进行实验.
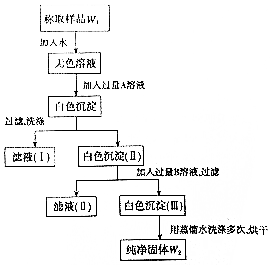 实验室有一瓶已部分被氧化的亚硫酸钠固体,为测定亚硫酸钠的质量分数,某同学设计如图所示实验.请根据实验步骤填写下列空白.
实验室有一瓶已部分被氧化的亚硫酸钠固体,为测定亚硫酸钠的质量分数,某同学设计如图所示实验.请根据实验步骤填写下列空白.