题目内容
以黄铁矿为原料生产硫酸的工艺流程图如下:
(1)已知: (已折算为标况下)SO3气体与H2O化合时放出的热量为 (保留两位有效数字)。
(已折算为标况下)SO3气体与H2O化合时放出的热量为 (保留两位有效数字)。
(2)沸腾炉中发生反应的化学方程式为 。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母) 。
a.沸腾炉排出的矿渣可供炼铁
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.为使黄铁矿充分燃烧,需将其粉碎
(4)在吸收塔吸收SO3不用水或稀硫酸的原因 。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。
①SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2吸收Br2的离子方程式是 。
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。部分测定结果如下表(a>0): 
计算:该铵盐中氮元素的质量分数是 %;若铵盐质量为15.00g,浓硫酸增加的质量为 。(计算结果保留两位小数)
(1)3.9×105kJ(2分) (2)4FeS2+11O2 4Fe2O3+8SO2(2分)(3)a b d(3分)
4Fe2O3+8SO2(2分)(3)a b d(3分)
(4)SO3与H2O化合时放出大量的热,用水或稀硫酸吸收容易形成酸雾,反而不利于充分吸收SO3(2分)
(5)①SO2+Br2+2H2O=4H++2Br-+SO42-(2分) ②14.56(2分)(14.56%不给分)
2.31g(2分)
解析试题分析:(1)根据热化学方程式可知SO3气体与H2O化合时放出的热量为 ×130.3kJ/mol=3.9×105kJ。
×130.3kJ/mol=3.9×105kJ。
(2)黄铁矿燃烧燃烧生成SO2和氧化铁,反应的化学方程式为FeS2+11O2 4Fe2O3+8SO2。
4Fe2O3+8SO2。
(3)生产过程中的矿渣中含有三氧化二铁,可以炼铁,a正确;增加空气的量会使平衡正向进行,提高了二氧化硫的转化率,b正确;催化剂只改变速率不改变平衡,不改变转化率,c不正确;粉碎矿石增大接触面积提高反应速率,d正确,所以正确答案选abd。
(4)由于SO3与H2O化合时放出大量的热,用水或稀硫酸吸收容易形成酸雾,反而不利于充分吸收SO3,所以在吸收塔吸收SO3不用水或稀硫酸。
(5)①单质溴具有氧化性,能把SO2氧化生成硫酸,而溴单质被还原为溴离子,因此反应的离子方程式是SO2+Br2+2H2O=4H++2Br-+SO42-。
②从吸收塔出来的气体用一定量氨水吸收,得到的铵盐产品是(NH4)2SO3和NH4HSO3的混合物;本反应历程是:OH-首先是和NH4HSO3中的H+反应,然后OH-再和NH4+反应放出氨气。由题知铵盐质量为30.00g时,产生0.68g÷17g/mol=0.04molNH3。该铵盐中NH4HSO4先与NaOH溶液反应,2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+H2O,只有当NH4HSO4中的H+消耗完全后,NH4+才能与NaOH溶液反应产生NH3,NH4++OH-=NH3↑+H2O。据此判断铵盐质量为10.00g时NaOH溶液过量,铵盐质量为20.00g和30.00g时,消耗的NaOH质量相等。设10.00g铵盐中NH4HSO4 与(NH4)2SO4的物质的量分别为X、Y,n(NH3)=n(OH-)-n(H+),则有:铵盐质量/g 10.00 20.00 30.00 40.00 含NH4HSO4、(NH4)2SO4/mol X、Y 2X、2Y 3X、3Y 4X、4Y 产生NH3/mol X+2Y X+2Y 0.04 0 消耗NaOH/mol 2X+2Y 3X+2Y 3X+0.04 3X+0.04
因此3X+2Y=3X+0.04,解得Y=0.02mol,又115X+132Y=10.00,得X=0.064mol.则该铵盐中氮元素的质量分数= ×100%=14.56%。
×100%=14.56%。
由上面讨论可知此NaOH溶液中共有0.232molNaOH,当铵盐质量为15.00g时含0.096mol NH4HSO4和0.03mol (NH4)2SO4,共有NH4+和H+ 0.252mol,故NaOH不足,此时产生n(NH3)=(0.232-0.096)mol=0.136mol,因此NH3的质量=0.136mol×17g/mol=2.31g。
考点:考查硫酸的工业制备、反应热的计算、反应条件的控制以及物质含量的计算

(1)硫元素有多种化合价,可形成多种化合物。填写下表中的空白:
| 化合价 | -2 | -1 | 0 | +2 | +4 | +6 | +7 |
| 代表物的化学式 | | FeS2 | S | Na2S2O3 | | SO3或H2SO4或Na2SO4 | Na2S2O8 |
(3)请按照浓度由大到小的顺序排列Na2SO3溶液中的离子: 。
Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或“不变”)。(不考虑水的蒸发)原因是
。
(4)某同学设计如下实验流程探究Na2S2O3的化学性质。

实验①可说明Na2S2O3能发生水解,实验②③说明Na2S2O3具有 性。请你预测Na2S2O3还可能具有的化学性质(列举2条即可) 、 。
某同学探究SO2有关性质。
(1)将SO2通入BaCl2溶液中,将所得溶液分成2份,在第一份中加入NaOH溶液,在第二份中滴入FeCl3溶液,两份都有白色沉淀。BaCl2溶液中通入SO2气体的现象为 。在第二份溶液中滴入FeCl3溶液时,SO2表现 性,反应的离子方程式为 ,生成沉淀的化学式为 。
(2)下列不能用来吸收SO2气体的是 。
| A.KMnO4(aq) | B.过量氨水 | C.石灰水 | D.盐酸 |
(4)硫原子33 16S的电子排布式为 。
(14分)
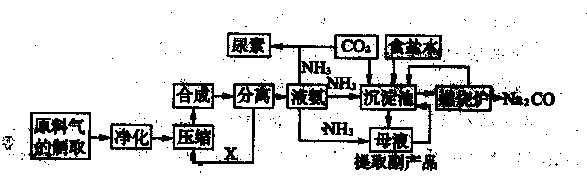
研究小组用下图装置制取Cl2,证明产生的气体中含有HCl。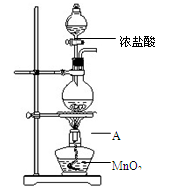
(1)仪器A的名称为 ;A中反应的离子方程式为 。
(2)甲同学将A中产生的气体通入下列溶液:
| 实验序号 | 试剂 | 现象 |
| a | 紫色石蕊溶液 | |
| b | AgNO3溶液 | 出现白色沉淀 |
②不能证明产生的气体中含有HCl的实验是 (填字母序号)。
(3)已知将HCl气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因: 。
(4)已知:2S2O32- + I2 ="==" S4O62- + 2I-。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。
I.测定X中溶解的Cl2。取25.00 mL溶液X,加入过量KI溶液,然后用0.04 mol?L-1 Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3溶液V mL。
II.测定X中Cl元素总量。另取25.00 mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl-,再用0.10 mol?L-1 AgNO3溶液滴定所得溶液中的Cl-。
X中的HClO不会影响I的测定结果,原因是 。
由I、II 中实验数据可证明A中产生的气体中含有HCl,则II中消耗0.10 mol?L-1 AgNO3溶液的体积应大于 mL(用含V的代数式表示)。
在实验室中可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中: ①为氯气发生装置;②的试管里盛有15mL 30% KOH 溶液.并置于热水浴中; ③的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中; ④的试管里加有紫色石蕊试液; ⑤为尾气吸收装置。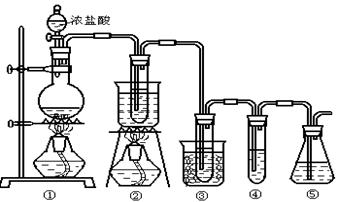
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过______(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_________(填写下列编号字母)的净化装置。
| A.碱石灰 | B.饱和食盐水 | C.浓硫酸 | D.饱和碳酸氢钠溶液 |
(3)本实验中制取次氯酸钠的离子方程式是: 。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | ______________________________________ |
| 然后溶液从无色逐渐变为 色 | _________________________________________ |
硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应△H>0)。某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。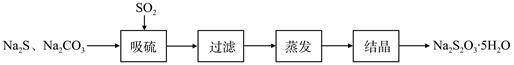
(1)吸硫装置如图所示。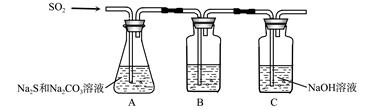
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 ,表明SO2吸收效率低的实验现象是B中溶液 。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 、 。(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,___________________。 | _______________ | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,___________________。 | _______________ | 样品含NaOH |
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取a g KIO3(化学式量:214)固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=_________mol·L-1。(只列出算式,不作运算)
已知:Cr2O72-+6I-+14H+= 2Cr3++3I2+7H2O 2S2O32-+I2=S4O62-+2I-
(4)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能 (填“无影响”、“偏低”或“偏高”),原因是 。