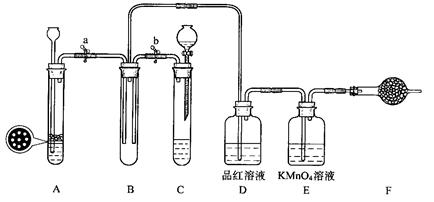
题目内容
某同学探究SO2有关性质。
(1)将SO2通入BaCl2溶液中,将所得溶液分成2份,在第一份中加入NaOH溶液,在第二份中滴入FeCl3溶液,两份都有白色沉淀。BaCl2溶液中通入SO2气体的现象为 。在第二份溶液中滴入FeCl3溶液时,SO2表现 性,反应的离子方程式为 ,生成沉淀的化学式为 。
(2)下列不能用来吸收SO2气体的是 。
| A.KMnO4(aq) | B.过量氨水 | C.石灰水 | D.盐酸 |
(4)硫原子33 16S的电子排布式为 。
(1)无明显现象。 还原性, 2Fe3++H2SO3+H2O=2Fe2++SO42-+4H+ , BaSO4
(2)D (3)96% (4)1s22s22p63s23p4
解析试题分析:(1)根据复分解反应发生的条件,由于酸性HCl>H2SO3 故SO2通入BaCl2溶液中不会与溶质发生反应,只与水反应生成H2SO3 故得到BaCl2、H2SO3混合液。再加入NaOH溶液时发生反应2NaOH+H2SO3=Na2SO3+H2O, Na2SO3和BaCl2发生离子反应生成BaSO3白色沉淀。另一份滴入FeCl3溶液,则发生氧化还原反应:2FeCl3+SO2+2H2O=2FeCl2+2HCl+H2SO4 , BaCl2与H2SO4生成 BaSO4白色沉淀。在该反应中SO2中S化合价升高,表现为还原性,反应的离子方程式为:2Fe3++H2SO3+H2O=2Fe2++SO42-+4H+ ,生成沉淀的化学式为BaSO4。
(2)SO2有还原性、酸性,能与KMnO4(aq)氨水、石灰水反应,可以吸收SO2有,盐酸不能反应,故不可以吸收,所以正确选项为D.
(3)发生反应:2SO2+O2= 2SO3用量差法求解。假设反应前总体积为100升,则SO2体积为7升,反应后总体积为96.64升根据方程式可看出若有2体积的SO2反应,反应后总体积减少1体积,现在减少100-96.64=3.36(升),则反应的SO2体积是6.72升,所以SO2的转化率为6.72L÷7L×100%=96%(4)S为16号元素,根据能级图可知其电子排布式为1s22s22p63s23p4.
考点:考查复分解反应、氧化还原反应、离子反应、可逆反应的反应物转化率、核外电子排布等知识。

 阅读快车系列答案
阅读快车系列答案
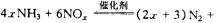
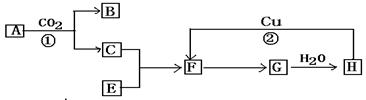
 。某化学兴趣小组模拟该处理过程的实验装置如下(夹持装置已略去):
。某化学兴趣小组模拟该处理过程的实验装置如下(夹持装置已略去):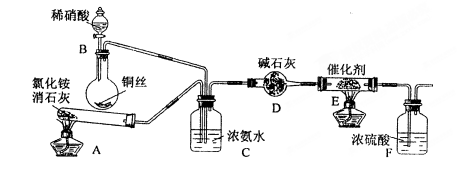

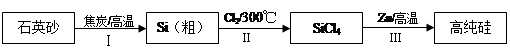
 Si(s) + 2ZnCl2(l) ΔH1 <0
Si(s) + 2ZnCl2(l) ΔH1 <0 

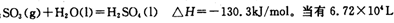 (已折算为标况下)SO3气体与H2O化合时放出的热量为 (保留两位有效数字)。
(已折算为标况下)SO3气体与H2O化合时放出的热量为 (保留两位有效数字)。