题目内容
硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应△H>0)。某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。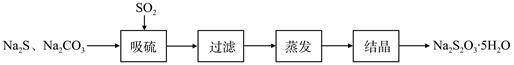
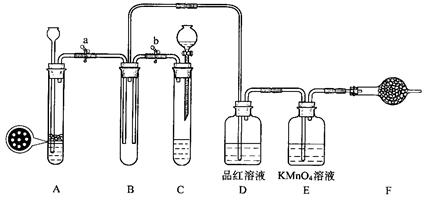
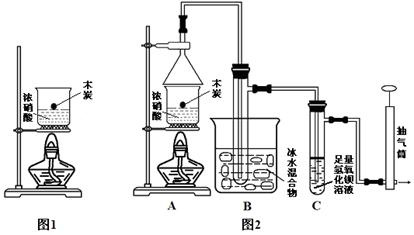
(1)吸硫装置如图所示。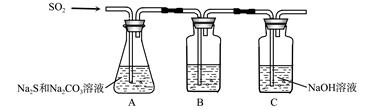
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 ,表明SO2吸收效率低的实验现象是B中溶液 。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 、 。(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,___________________。 | _______________ | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,___________________。 | _______________ | 样品含NaOH |
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取a g KIO3(化学式量:214)固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=_________mol·L-1。(只列出算式,不作运算)
已知:Cr2O72-+6I-+14H+= 2Cr3++3I2+7H2O 2S2O32-+I2=S4O62-+2I-
(4)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能 (填“无影响”、“偏低”或“偏高”),原因是 。
(1)①品红、溴水或KMnO4溶液;溶液颜色很快褪色或指出相应试剂的正确颜色(红色、黄色等)很快褪色也可得分。 (2分,每个1分)
②增大SO2的接触面积、控制SO2的流速、适当升高温度(答其中二条即可)(4分,每个2分)
(2)(8分,每个2分)序号 实验操作 预期现象 ① 滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡。 有白色沉淀生成 ② 加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH 有白色沉淀生成,上层清液pH大于10.2
(3)6000a/214V 或3000a/107V (其它正确答案也给分) (2分)
(4)偏高;4I—+4H++O2=2I2+2H2O
解析试题分析:(1)①由于SO2具有还原性、漂白性,因此若 装置B的作用是检验装置A中SO2的吸收效率,则B中试剂可以是品红、溴水或KMnO4溶液,表明SO2吸收效率低的实验现象是B中溶液溶液颜色很快褪色。
②要使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是增大SO2的接触面积、控制SO2的流速、适当升高温度等。
(2)氯离子的检验可以利用硝酸酸化的硝酸银溶液;由于饱和碳酸钙溶液的pH=10.2,所以可以先进入氯化钙溶液,然后测量溶液的pH值进行对比即可,因此答案为:序号 实验操作 预期现象 ① 滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡。 有白色沉淀生成 ② 加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH 有白色沉淀生成,上层清液pH大于10.2
(3)ag硝酸钾的物质的量是 mol,则根据反应式IO3-+5I-+6H+=3I2+3H2O、2S2O32-+I2=S4O62-+2I-可知:IO3-~~~~~6S2O32-
mol,则根据反应式IO3-+5I-+6H+=3I2+3H2O、2S2O32-+I2=S4O62-+2I-可知:IO3-~~~~~6S2O32-
1mol 6mol mol
mol  mol×6
mol×6
所以c(Na2S2O3)= mol/L=
mol/L=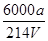 mol/L
mol/L
(4)由于碘离子易被氧化:4I—+4H++O2=2I2+2H2O,因此如果第三步滴速太慢,则导致消耗的硫代硫酸钠溶液的体积增加,从而导致其浓度偏高。
考点:考查二氧化硫的性质、外界条件对反应速率的影响、物质检验以及氧化还原滴定的有关计算与误差分析

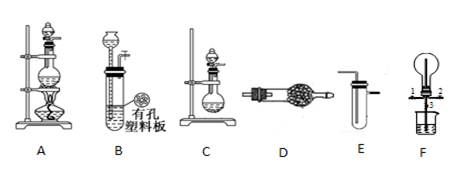
化学实验要符合“绿色化学”理念。某实验小组对“铜与浓硝酸反应”进行了探究性实验。试回答下列问题: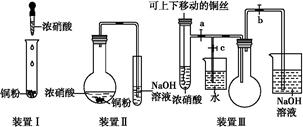
(1)写出铜和浓硝酸反应的离子方程式: 。
(2)与装置Ⅰ相比,装置Ⅱ的优点是 ,装置Ⅲ除具有装置Ⅱ的优点外,还有的优点是 。
(3)在装置Ⅲ中,若使NO2气体充满烧瓶,应先关闭弹簧夹 ,再打开弹簧夹 ;当气体充满烧瓶后,将铜丝提起,然后把a、b、c都关闭,并把烧瓶置于沸水中,下列情况不变的是 。
| A.颜色 |
| B.质量 |
| C.气体的平均相对分子质量 |
| D.密度 |
(4)为了验证NO2与水的反应,欲使烧杯中的水进入烧瓶的操作是 。

 (已折算为标况下)SO3气体与H2O化合时放出的热量为 (保留两位有效数字)。
(已折算为标况下)SO3气体与H2O化合时放出的热量为 (保留两位有效数字)。