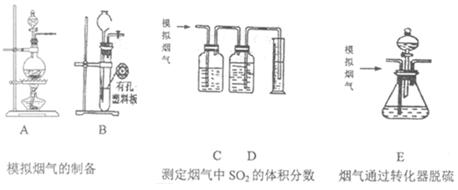
题目内容
随着世界粮食需求量的增加,农业对化学肥料的需求越越大。氮肥是需求最大的一种化肥。氮肥的生产和合理施用在农业生产中起着重大作用。合成氨及化肥生产流程示意图如下: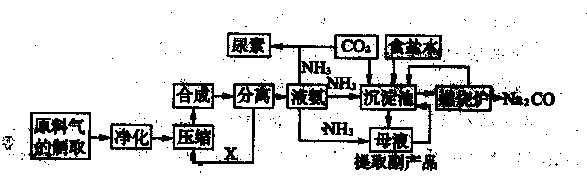
(1)目前,工业上用铁触媒作催化剂,在20~50 MPa、450℃左右用氮、氢混合气体在
中进行合成氨。则沿X方向回去的物质是 。
(2)在侯氏制碱法中,从沉淀池中得到的母液要通人氨气、降温并加入 (填化学式),目的是 。
(3)沉淀池中的化学方程式是 。
(4)工业上将氨催化氧化可制硝酸。在硝酸生产中,催化剂铂网在氨的催化氧化反应中起的作 用是 。硝酸工业尾气对环境污染严重,若在催化剂存在下用甲烷将其中的一氧化氮还原为对空气无污染的物质,其反应的化学方程式为 。
(1)(2分)合成塔(1分);H2、N2(1分)
(2)(2分)NaCl (1分);使氯化铵逐步从母液中结晶析出(1分)
(3)(2分)NH3 + CO2 + H2O +NaCl = NH4Cl + NaHCO3↓
(4)(2分)加快反应速率同时决定了氧化产物是一氧化氮(1分);
CH4 + 4NO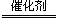 2N2 + CO2 + 2H2O (1分)
2N2 + CO2 + 2H2O (1分)
解析试题分析:(1)氮气和氢气的反应在合成塔中进行,因为合成氨反应为可逆反应,反应后化合物中含有一定量的的氮气和氢气 ,分离后再作为原料进行循环利用。
(2)加入氯化钠,利用同离子效应,降低氯化铵的溶解度,使氯化铵结晶析出。
(3)根据流程图和题目所给信息,可知反应物有NH3、CO2、H2O、NaCl,产物为NH4Cl 和 NaHCO3,进而可写出化学方程式。
(4)催化剂的作用为加快化学反应速率,同时生成NO;根据化合价的变化,甲烷将其中的一氧化氮还原为对空气无污染的物质,生成N2、CO2、H2O ,配平可得化学方程式。
考点:本题考查化学工艺流程、化学方程式的书写及催化剂的作用。

 阅读快车系列答案
阅读快车系列答案碳及其化合物有广泛的用途。
(1)在电化学中,常用碳作电极:
①在酸性锌锰干电池中,碳棒作 极。
②若用碳棒和铁棒做电极电解饱和食盐水生产烧碱时,碳棒作 极,反应的离子方程式 。
(2)将水蒸气通过红热的碳可产生水煤气:C(s)+H2O(g)  CO(g)+H2(g) △H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是 。
CO(g)+H2(g) △H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是 。
| A.升高温度 | B.增加碳的用量 |
| C.加入催化剂 | D.用CO吸收剂除去CO |
 CO2(g)+H2(g)得到如下数据:
CO2(g)+H2(g)得到如下数据:| 温度/℃ | 起始浓度mol/L | 平衡浓度mol/L | |
| CO(g) | H2O(g) | H2(g) | |
| 900 | 2.0 | 0.8 | 0.4 |
通过计算,该反应的平衡常数为: 。
(4)工业上把水煤气中的混合气体处理后,获得较纯的H2用于合成氨:
N2(g)+3H2(g)一定条件下2NH3(g) △H= —92.4kJ/mol某同学在不同实验条件下模拟化工生产进行实验,N2浓度随时间变化如图:
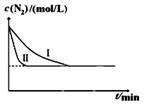
①与实验I比较,实验II改变的条件为: 。
②实验III比实验I的温度要高,其它条件相同,请在下图画出实验I和实验III中NH3浓度随时间变化的示意图。




 Si(s) + 2ZnCl2(l) ΔH1 <0
Si(s) + 2ZnCl2(l) ΔH1 <0 

 (已折算为标况下)SO3气体与H2O化合时放出的热量为 (保留两位有效数字)。
(已折算为标况下)SO3气体与H2O化合时放出的热量为 (保留两位有效数字)。