题目内容
(1)硫元素有多种化合价,可形成多种化合物。填写下表中的空白:
| 化合价 | -2 | -1 | 0 | +2 | +4 | +6 | +7 |
| 代表物的化学式 | | FeS2 | S | Na2S2O3 | | SO3或H2SO4或Na2SO4 | Na2S2O8 |
(3)请按照浓度由大到小的顺序排列Na2SO3溶液中的离子: 。
Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或“不变”)。(不考虑水的蒸发)原因是
。
(4)某同学设计如下实验流程探究Na2S2O3的化学性质。

实验①可说明Na2S2O3能发生水解,实验②③说明Na2S2O3具有 性。请你预测Na2S2O3还可能具有的化学性质(列举2条即可) 、 。
(1)(2分)化合价 -2 -1 0 +2 +4 +6 +7 代表物的化学式 Na2S或H2S等 SO2或Na2SO3
(2)HSO3-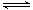 H++SO32-、HSO3-+H2O
H++SO32-、HSO3-+H2O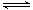 H2SO3+OH-、H2O
H2SO3+OH-、H2O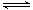 H++OH-;(3分,每个方程式1分)
H++OH-;(3分,每个方程式1分)
(3)c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)(2分);减小(1分);2SO32-+O2=2SO42-,SO32-被氧化生成SO42-,SO32-的浓度减小,水解产生的OH-浓度减小,溶液pH减小;(2分,只要叙述合理,不写方程式也得分)
(4)还原;具有氧化性、沉淀性(或能与阳离子结合产生沉淀)、络合性(或能形成络合物)、能发生歧化反应(或既具有氧化性又具有还原性)。(答对一条1分,共3分,错误不得分,只要合理即可得分)
解析试题分析:(1)硫元素表现-2价,有硫化钠等,硫元素表现+4价,有二氧化硫、亚硫酸盐等,故答案为:Na2S等;SO2等;
(2)溶液中存在水的电离平衡、亚硫酸氢根的电离平衡与水解平衡,平衡反应的离子方程式分别为HSO3-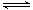 H++SO32-、HSO3-+H2O
H++SO32-、HSO3-+H2O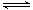 H2SO3+OH-、H2O
H2SO3+OH-、H2O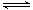 H++OH-,
H++OH-,
(3)Na2SO3溶液亚硫酸根水解得到亚硫酸氢根,溶液呈碱性,亚硫酸根氢根水解得到亚硫酸,同时存在水的电离,故溶液中氢氧根离子的浓度大于亚硫酸氢根离子,碱性条件下,氢离子浓度原小于亚硫酸氢根离子浓度,水解程度不大,亚硫酸根浓度大于氢氧根离子浓度,故溶液中离子浓度大小关系为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),
Na2SO3溶液放置于空气中一段时间后,SO32-被氧化生成SO42-,SO32-的浓度减小,水解产生的OH-浓度减小,溶液pH减小,
(4)Na2S2O3溶液与氯化钡溶液混合后,没有明显现象,加入氯水,有白色沉淀生成,该沉淀为硫酸钡,反应中硫元素的化合价升高,Na2S2O3表现还原性;
Na2S2O3中硫元素的化合价处于中间价态,具有氧化性、还原性,可能发生歧化反应等.
考点:本题考查硫元素化合物的性质、常用化学用语、盐类水解、离子浓度比较等。

 阅读快车系列答案
阅读快车系列答案
 + Cl-+ H2O
+ Cl-+ H2O


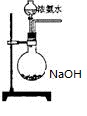
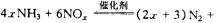
 。某化学兴趣小组模拟该处理过程的实验装置如下(夹持装置已略去):
。某化学兴趣小组模拟该处理过程的实验装置如下(夹持装置已略去):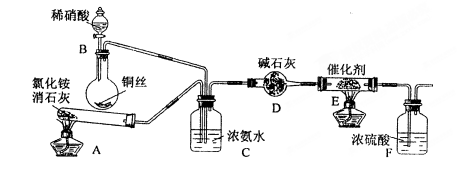

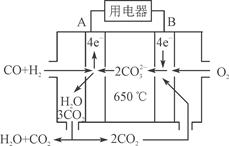

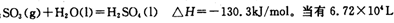 (已折算为标况下)SO3气体与H2O化合时放出的热量为 (保留两位有效数字)。
(已折算为标况下)SO3气体与H2O化合时放出的热量为 (保留两位有效数字)。