题目内容
在实验室中可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中: ①为氯气发生装置;②的试管里盛有15mL 30% KOH 溶液.并置于热水浴中; ③的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中; ④的试管里加有紫色石蕊试液; ⑤为尾气吸收装置。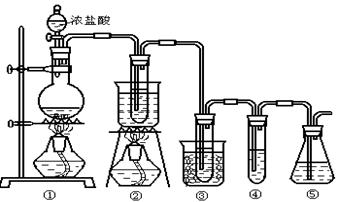
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过______(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_________(填写下列编号字母)的净化装置。
| A.碱石灰 | B.饱和食盐水 | C.浓硫酸 | D.饱和碳酸氢钠溶液 |
(3)本实验中制取次氯酸钠的离子方程式是: 。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | ______________________________________ |
| 然后溶液从无色逐渐变为 色 | _________________________________________ |
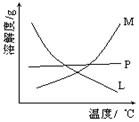
(1)分液漏斗 B (2)反应物浓度不同,反应温度不同 M 过滤
(3)Cl2+OH-=ClO-+Cl-+H2O
(4)实验现象 原因 溶液最初从紫色逐渐变为 红 色
氯气与水反应生成的H+使石蕊变色
随后溶液逐渐变为无色
氯气与水反应生成次氯酸,次氯酸具有强氧化性,可以把石蕊氧化为无色然后溶液从无色逐渐变为 黄绿色 色
继续通入的氯气溶于水形成氯水,呈黄绿色溶液
解析试题分析:⑴制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗主要是方便控制反应的起始和终止。氯气在饱和食盐水中的溶解度比较小,氯化氢的比较大,因此可以选用饱和食盐水来吸收氯化氢。比较制取氯酸钾和次氯酸钠的条件.二者的差异是反应物浓度不同,反应温度不同。氯酸钾和次氯酸钠的溶解度随温度的升高二增大,因此符合该晶体溶解度曲线的是M。制备次氯酸盐一般选择氯气与相应的碱反应制备,因此Cl2+OH-=ClO-+Cl-+H2O。溶液最初从紫色逐渐变为红色主要是因为氯气与水反应生成的H+使石蕊变色。随后溶液逐渐变为无色主要是氯气与水反应生成次氯酸,次氯酸具有强氧化性,可以把石蕊氧化为无色然后溶液从无色逐渐变为黄绿色,主要是由于继续通入的氯气溶于水形成氯水,呈黄绿色溶液。
考点:考查氯的重要化合物的相关知识点。

碳及其化合物有广泛的用途。
(1)在电化学中,常用碳作电极:
①在酸性锌锰干电池中,碳棒作 极。
②若用碳棒和铁棒做电极电解饱和食盐水生产烧碱时,碳棒作 极,反应的离子方程式 。
(2)将水蒸气通过红热的碳可产生水煤气:C(s)+H2O(g)  CO(g)+H2(g) △H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是 。
CO(g)+H2(g) △H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是 。
| A.升高温度 | B.增加碳的用量 |
| C.加入催化剂 | D.用CO吸收剂除去CO |
 CO2(g)+H2(g)得到如下数据:
CO2(g)+H2(g)得到如下数据:| 温度/℃ | 起始浓度mol/L | 平衡浓度mol/L | |
| CO(g) | H2O(g) | H2(g) | |
| 900 | 2.0 | 0.8 | 0.4 |
通过计算,该反应的平衡常数为: 。
(4)工业上把水煤气中的混合气体处理后,获得较纯的H2用于合成氨:
N2(g)+3H2(g)一定条件下2NH3(g) △H= —92.4kJ/mol某同学在不同实验条件下模拟化工生产进行实验,N2浓度随时间变化如图:
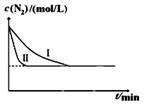
①与实验I比较,实验II改变的条件为: 。
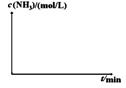
②实验III比实验I的温度要高,其它条件相同,请在下图画出实验I和实验III中NH3浓度随时间变化的示意图。
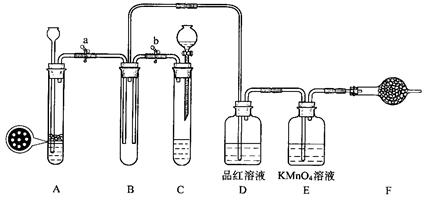
某小组同学用下图装置进行实验研究(a、b、c表示止水夹).请评价或完善其方案: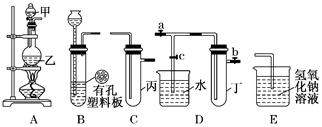
将装置A、C、E相连接,用MnO2和浓盐酸制取氯气,请回答:
①.氯元素在周期表中的位置为 。
②.A中反应的离子方程式:___ _。
③.E中氢氧化钠溶液的作用__________ 。
在C中加入适量的水可制得氯水.将所得氯水分成两份进行实验,其操作、现象和结论为:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物具有酸性 |
⑤.实验Ⅱ推出相应的结论是否合理?_________,若不合理,请说明理由(若合理,无需填写)____________________________________ ____________________。
(2) 为比较Cl2和I2的氧化性强弱,将A、C、E相连, C中盛的试剂可以为___ _ __。
(3) 将B、D、E相连,在B中装浓硝酸和铜片,可制得NO2并进行有关实验.
①.B中反应的化学方程式_____________________ ______ __________。
②.先若关闭c,当丁中充满红棕色的NO2时,再关闭止水夹a、b,微热试管丁, 丁中可观察到的实验现象 。


 (已折算为标况下)SO3气体与H2O化合时放出的热量为 (保留两位有效数字)。
(已折算为标况下)SO3气体与H2O化合时放出的热量为 (保留两位有效数字)。