题目内容
13.33.6gNaHCO3受热分解放出气体在标况下的体积是多少?将放出气体通入过量的澄清石灰水中,得到的沉淀的物质的量是多少?(写出计算过程)分析 NaHCO3受热分解,发生反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,根据n=$\frac{m}{M}$计算NaHCO3的物质的量,根据方程式计算生成二氧化碳的物质的量,根据V=nVm计算二氧化碳的体积;二氧化碳通入足量的石灰水,发生反应Ca(OH)2+CO2═CaCO3↓+H2O,根据方程式计算生成碳酸钙的物质的量.
解答 解:33.6gNaHCO3的物质的量=$\frac{33.6g}{84g/mol}$=0.4mol,
设碳酸氢钠分解生成的二氧化碳为xmol,则:
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
2 1
0.4mol xmol
故$\frac{2}{1}$=$\frac{0.4}{x}$,解得x=0.2
故二氧化碳的体积为0.2mol×22.4L/mol=4.48L,
设生成碳酸钙的物质的量为ymol,则:
Ca(OH)2+CO2═CaCO3↓+H2O
1 1
0.2mol ymol
故$\frac{1}{0.2}$=$\frac{1}{y}$,解得y=0.2,
答:在标况下生成气体的体积是4.48L.得到的沉淀的物质的量是0.2mol.
点评 本题考查根据方程式进行的计算,比较基础,掌握发生的反应是关键.

练习册系列答案
相关题目
1.某水溶液中可能存在Na+、Al3+、Fe2+、NH4+、NO3-、CO32-、SO42-中的若干种离子,且各离子的物质的量相同.取该溶液进行如下实验:
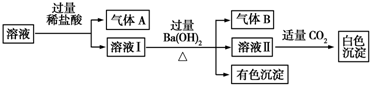
下列判断正确的是( )

下列判断正确的是( )
| A. | A是CO2,B是NH3 | |
| B. | 白色沉淀一定是Al(OH)3 | |
| C. | 溶液中一定存在Al3+、Fe2+、NO3-、NH4+ | |
| D. | 溶液中一定不存在Na+ |
8.在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是( )
| A. | AlCl3 | B. | 碳酸氢钠 | C. | 硫酸镁 | D. | 高锰酸钾 |
18.下列反应类型与苯和浓硝酸反应类型相同的是( )
| A. | 甲烷和氯气混合并光照 | B. | 乙醇和酸性高锰酸钾溶液的反应 | ||
| C. | 乙烯生成聚乙烯 | D. | 苯和氢气反应生成环己烷 |
5.用高铁酸钠(Na2FeO4)对河水、湖水消毒,是城市饮用水消毒的新技术.已知制备高铁酸钠的反应为Fe2O3+3Na2O2═2Na2FeO4+Na2O,下列说法正确的是( )
| A. | Na2O2 既是氧化剂,又是还原剂 | |
| B. | Fe2O3在反应中得到电子 | |
| C. | 3 mol Na2O2参加反应,转移的电子总数为12mol | |
| D. | Na2FeO4能消毒杀菌,因其具有强氧化性 |
3.可逆反应在一定条件下达到化学平衡时,下列说法不正确的是( )
| A. | 正反应速率等于逆反应速率 | B. | 各组分浓度不再发生变化 | ||
| C. | 反应体系中某组分的组成保持不变 | D. | 正、逆反应速率都为零 |
 .
. ,A2C的结构式:H-O-H.
,A2C的结构式:H-O-H. .
.

 侧链上可能发生反应的类型:加成反应、氧化反应、还原反应、聚合反应等.(任填两种)
侧链上可能发生反应的类型:加成反应、氧化反应、还原反应、聚合反应等.(任填两种)