题目内容
8.在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是( )| A. | AlCl3 | B. | 碳酸氢钠 | C. | 硫酸镁 | D. | 高锰酸钾 |
分析 物质的溶液在蒸发皿中加热蒸干并灼烧,最后得到该物质固体,如果是盐,说明该物质为难挥发性酸的盐,且该盐较稳定,受热不易发生反应,据此分析解答.
解答 解:A.氯化铝易水解生成氢氧化铝和HCl,升高温度HCl易挥发,蒸干溶液得到的固体是氢氧化铝,灼烧氢氧化铝,氢氧化铝分解生成氧化铝,所以最终得到的固体是氧化铝,故A不选;
B.碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,故B不选;
C.形成硫酸镁的酸是硫酸,硫酸属于难挥发性酸,且硫酸镁较稳定,受热不发生反应,所以加热蒸干灼烧硫酸镁溶液最后得到的仍然是硫酸镁,故C选;
D.高锰酸钾不稳定,受热易分解生成锰酸钾、二氧化锰和氧气,所以得不到原来物质,故D不选;
故选C.
点评 本题考查盐类水解的应用,侧重考查物质性质,加热蒸干灼烧易挥发性酸的盐最终得到的物质是金属氧化物,加热蒸干灼烧难挥发性酸的盐且该盐不易发生反应时得到其物质本身,题目难度不大.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
19. 已知下列数据:
已知下列数据:
学生在实验室制取乙酸乙酯的主要步骤如下:
①在30mL的大试管A中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合溶液;
②按图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10min;
③待试管B收集到一定量的产物后停止加热,撤去试管B并用力振荡,然后静置待分层;
④分离出乙酸乙酯层、洗涤、干燥.
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为在大试管中先加4 mL乙醇,再缓慢加入1 mL浓H2SO4,边加边振荡,待冷至室温后,再加4 mL乙酸并摇匀.
(2)上述实验中饱和碳酸钠溶液的作用是(填字母)BC.
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热操作,其主要理由是防止反应物随生成物一起大量被蒸出来,导致原料损失,及发生副反应.
(4)分离出乙酸乙酯后,为了干燥乙酸乙酯可选用的干燥剂为(填字母)B.
A.P2O5 B.无水Na2SO4
C.碱石灰 D.NaOH固体
(5)浓硫酸的作用是:①催化作用;②吸水作用.
(6)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止倒吸.
(7)若要把制得的乙酸乙酯分离出来,应采用的实验操作是用饱和碳酸钠溶液承接蒸馏出的乙酸乙酯,再分液.
(8)某同学将收集到的乙酸乙酯滴入饱和NaHCO3溶液中,观察到有少量气泡产生,可得出的结论是乙酸乙酯中含有乙酸,该过程中发生反应的化学方程式是CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O.
 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
①在30mL的大试管A中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合溶液;
②按图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10min;
③待试管B收集到一定量的产物后停止加热,撤去试管B并用力振荡,然后静置待分层;
④分离出乙酸乙酯层、洗涤、干燥.
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为在大试管中先加4 mL乙醇,再缓慢加入1 mL浓H2SO4,边加边振荡,待冷至室温后,再加4 mL乙酸并摇匀.
(2)上述实验中饱和碳酸钠溶液的作用是(填字母)BC.
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热操作,其主要理由是防止反应物随生成物一起大量被蒸出来,导致原料损失,及发生副反应.
(4)分离出乙酸乙酯后,为了干燥乙酸乙酯可选用的干燥剂为(填字母)B.
A.P2O5 B.无水Na2SO4
C.碱石灰 D.NaOH固体
(5)浓硫酸的作用是:①催化作用;②吸水作用.
(6)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止倒吸.
(7)若要把制得的乙酸乙酯分离出来,应采用的实验操作是用饱和碳酸钠溶液承接蒸馏出的乙酸乙酯,再分液.
(8)某同学将收集到的乙酸乙酯滴入饱和NaHCO3溶液中,观察到有少量气泡产生,可得出的结论是乙酸乙酯中含有乙酸,该过程中发生反应的化学方程式是CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O.
16.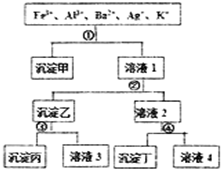 某溶液含有Fe3+、Al3+、Ba2+、Ag+、K+五种阳离子,现用过量的H2SO4、NaOH、NH3•H2O、NaCl四种溶液,按图所示步骤分开五种离子.下列判断正确的是( )
某溶液含有Fe3+、Al3+、Ba2+、Ag+、K+五种阳离子,现用过量的H2SO4、NaOH、NH3•H2O、NaCl四种溶液,按图所示步骤分开五种离子.下列判断正确的是( )
 某溶液含有Fe3+、Al3+、Ba2+、Ag+、K+五种阳离子,现用过量的H2SO4、NaOH、NH3•H2O、NaCl四种溶液,按图所示步骤分开五种离子.下列判断正确的是( )
某溶液含有Fe3+、Al3+、Ba2+、Ag+、K+五种阳离子,现用过量的H2SO4、NaOH、NH3•H2O、NaCl四种溶液,按图所示步骤分开五种离子.下列判断正确的是( )| A. | 沉淀乙是氢氧化铝和氢氧化银的混合物 | |
| B. | 溶液3中含有Al3+ | |
| C. | 试剂①是NaCl,试剂④是H2SO4 | |
| D. | 溶液4含有三种阳离子,分别是H+、Na+、K+ |
3.下列关于弱电解质的说法中,正确的是( )
| A. | 弱电解质需要通电才能发生电离 | |
| B. | 醋酸达到电离平衡时,不存在:CH3COO-+H+?CH3COOH | |
| C. | H2SO4是共价化合物,所以它是弱电解质 | |
| D. | 弱电解质溶液中,既有溶质分子,又有溶质电离出来的离子 |
20.下列各组中,不管以何种比例混合,只要总质量一定,充分燃烧后生成的二氧化碳的量不变的是( )
| A. | 乙烯和苯 | B. | 乙醇和丙醇(CH3CH2CH2OH) | ||
| C. | 乙醇和乙醚(C2H5OC2H5) | D. | 甲醛(HCHO)和乙酸 |
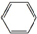
17.下列不属于有机物的是( )
| A. |  | B. | C6H6 | C. | CCl4 | D. |  |
18.如图所示的实验,能达到实验目的是( )
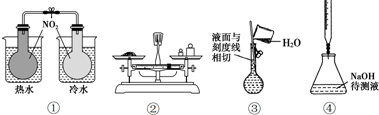

| A. | ①验证温度对平衡移动的影响 | B. | ②称量5.120gNaCl固体 | ||
| C. | ③配制一定物质的量浓度NaCl溶液 | D. | ④中和滴定 |
 .
. ,取代反应.
,取代反应.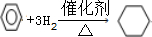 ,加成反应.
,加成反应.