题目内容
(1)元素A是第三周期ⅦA族元素,A元素与另两种非金属元素可组成离子化合物甲.写出甲的电子式 .
(2)在所有的气态氢化物中,元素B的氢化物最稳定,写出元素B在周期表中的位置 .
(3)金属元素C形成的某化合物的溶液常用于检验CO2,则元素C的简单离子与元素A的简单离子的半径大小关系是 (用离子符号表示),元素D的原子序数比元素C小8,写出元素D的单质在CO2中燃烧的化学方程式 .
(4)元素E是第三周期中简单离子半径最小的元素,元素F是第三周期中原子半径最大的元素,写出元素E的单质与元素F的最高价氧化物对应水化物反应的离子方程式 .
(2)在所有的气态氢化物中,元素B的氢化物最稳定,写出元素B在周期表中的位置
(3)金属元素C形成的某化合物的溶液常用于检验CO2,则元素C的简单离子与元素A的简单离子的半径大小关系是
(4)元素E是第三周期中简单离子半径最小的元素,元素F是第三周期中原子半径最大的元素,写出元素E的单质与元素F的最高价氧化物对应水化物反应的离子方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:(1)元素A是第三周期ⅦA族元素,则A为氯元素,它与另两种非金属元素可组成离子化合物甲,则甲为氯化铵,据此答题;
(2)在所有的气态氢化物中,氟元素的非金属性最强,所以氟元素的氢化物最稳定,故B为氟元素,据此答题;
(3)通常用澄清石灰水检验CO2,所以C为钙元素,元素D的原子序数比元素C小8,则D为镁元素,据此答题;
(4)元素E是第三周期中简单离子半径最小的元素,则E为铝元素,元素F是第三周期中原子半径最大的元素,则F为钠元素,据此答题;
(2)在所有的气态氢化物中,氟元素的非金属性最强,所以氟元素的氢化物最稳定,故B为氟元素,据此答题;
(3)通常用澄清石灰水检验CO2,所以C为钙元素,元素D的原子序数比元素C小8,则D为镁元素,据此答题;
(4)元素E是第三周期中简单离子半径最小的元素,则E为铝元素,元素F是第三周期中原子半径最大的元素,则F为钠元素,据此答题;
解答:
解:(1)元素A是第三周期ⅦA族元素,则A为氯元素,它与另两种非金属元素可组成离子化合物甲,则甲为氯化铵,氯化铵的电子式为: ,故答案为:
,故答案为: ;
;
(2)在所有的气态氢化物中,氟元素的非金属性最强,所以氟元素的氢化物最稳定,故B为氟元素,氟位于元素周期表中第二周期第ⅤⅡA族,故答案为:第二周期第ⅤⅡA族;
(3)通常用澄清石灰水检验CO2,所以C为钙元素,元素D的原子序数比元素C小8,则D为镁元素,根据元素周期律,电子层结构相同时,核电荷数越大,离子半径越小,所以钙离子半径小于氯离子,镁在二氧化碳中燃烧生成氧化镁和碳,化学方程式为2Mg+CO2
2MgO+C,故答案为:Ca2+<Cl-;2Mg+CO2
2MgO+C;
(4)铝和氢氧化钠反应生成偏铝酸钠和氢气,离子反应方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
 ,故答案为:
,故答案为: ;
;(2)在所有的气态氢化物中,氟元素的非金属性最强,所以氟元素的氢化物最稳定,故B为氟元素,氟位于元素周期表中第二周期第ⅤⅡA族,故答案为:第二周期第ⅤⅡA族;
(3)通常用澄清石灰水检验CO2,所以C为钙元素,元素D的原子序数比元素C小8,则D为镁元素,根据元素周期律,电子层结构相同时,核电荷数越大,离子半径越小,所以钙离子半径小于氯离子,镁在二氧化碳中燃烧生成氧化镁和碳,化学方程式为2Mg+CO2
| ||
| ||
(4)铝和氢氧化钠反应生成偏铝酸钠和氢气,离子反应方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
点评:本题主要考查了电子式、元素周期表、化学方程式、离子反应等知识,难度不大,解时注意根据元素周期律确定元素的种类.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
下列有关物质结构的表述正确的是( )
A、次氯酸的电子式 |
B、硅原子价电子排布图为 |
| C、硫离子的最外层电子排布式3s23p4 |
D、钠离子的结构示意图: |
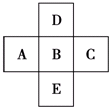 如图所示,已知A元素的最低化合价为-3价,D元素和B元素可形成2种化合物.试回答下列问题(均用具体的元素符号回答):
如图所示,已知A元素的最低化合价为-3价,D元素和B元素可形成2种化合物.试回答下列问题(均用具体的元素符号回答):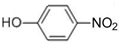 ⑥
⑥ ⑦I2 ⑧H2O2 ⑨SiO2 ⑩NH4Cl
⑦I2 ⑧H2O2 ⑨SiO2 ⑩NH4Cl 可用来制备抗凝血药,通过如图路线合成:
可用来制备抗凝血药,通过如图路线合成: