题目内容
已知A、B、C、D四元素的核电荷数依次增加,它们的离子的电子层数相同且最外层电子数均为8.A原子的L层电子数与K、M层电子数之和相等,D原子的K、L层电子数之和等于电子总数的一半.完成以下问题:
(1)写元素符号A: ;B: ;C: ;D: .它们原子半径由大到小的顺序是 .(用元素符号作答)
(2)写出四元素的离子结构示意图A: ;B: ; C: ;D: .它们离子的半径由大到小的顺序为 (用离子符号作答).
(3)写出最高价氧化物对应水化物化学式: 、 、 、 .
(4)写出气态氢化物分子式: .比较其稳定性大小: .
(1)写元素符号A:
(2)写出四元素的离子结构示意图A:
(3)写出最高价氧化物对应水化物化学式:
(4)写出气态氢化物分子式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D 4种元素的核电荷数依次增大,A原子的L层电子数与K、M层电子数之和相等,则M层电子数=8-2=6,故A为S元素;D原子的K、L层电子数之和等于电子总数的一半,则L层已经排满电子,故核外电子数=2×(2+8)=20,故D为Ca元素,四元素的离子的电子层数相同且最外层电子数均为8,结合原子序数,可推知,B为Cl、C为K,据此解答.
解答:
解:A、B、C、D 4种元素的核电荷数依次增大,A原子的L层电子数与K、M层电子数之和相等,则M层电子数=8-2=6,故A为S元素;D原子的K、L层电子数之和等于电子总数的一半,则L层已经排满电子,故核外电子数=2×(2+8)=20,故D为Ca元素,四元素的离子的电子层数相同且最外层电子数均为8,结合原子序数,可推知,B为Cl、C为K,
(1)由上述分析可知,A为S,B为Cl,C为K,D为Ca,同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径由大到小的顺序是:r(K)>r(Ca)>r(S)>r(Cl),
故答案为:S;Cl;K;Ca;r(K)>r(Ca)>r(S)>r(Cl);
(2)S、Cl、K、Ca对应的离子结构示意图为 、
、 、
、 、
、 ,电子层结构相同,核电荷数越大,离子半径越小,故离子半径r(S2-)>r(Cl-)>r(K+)>r(Ca2+),
,电子层结构相同,核电荷数越大,离子半径越小,故离子半径r(S2-)>r(Cl-)>r(K+)>r(Ca2+),
故答案为: 、
、 、
、 、
、 ;r(S2-)>r(Cl-)>r(K+)>r(Ca2+);
;r(S2-)>r(Cl-)>r(K+)>r(Ca2+);
(3)S、Cl、K、Ca对应的最高价氧化物对应水化物化学式为H2SO4、HClO4、KOH、Ca(OH)2,故答案为:H2SO4、HClO4、KOH、Ca(OH)2;
(4)S、Cl对应的气态氢化物分子式为HCl、H2S,同周期自左而右金属性减弱、非金属性增强,氢化物稳定性增强,所以它们的稳定性顺序为HCl>H2S,
故答案为:HCl>H2S;
(1)由上述分析可知,A为S,B为Cl,C为K,D为Ca,同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径由大到小的顺序是:r(K)>r(Ca)>r(S)>r(Cl),
故答案为:S;Cl;K;Ca;r(K)>r(Ca)>r(S)>r(Cl);
(2)S、Cl、K、Ca对应的离子结构示意图为
 、
、 、
、 、
、 ,电子层结构相同,核电荷数越大,离子半径越小,故离子半径r(S2-)>r(Cl-)>r(K+)>r(Ca2+),
,电子层结构相同,核电荷数越大,离子半径越小,故离子半径r(S2-)>r(Cl-)>r(K+)>r(Ca2+),故答案为:
 、
、 、
、 、
、 ;r(S2-)>r(Cl-)>r(K+)>r(Ca2+);
;r(S2-)>r(Cl-)>r(K+)>r(Ca2+);(3)S、Cl、K、Ca对应的最高价氧化物对应水化物化学式为H2SO4、HClO4、KOH、Ca(OH)2,故答案为:H2SO4、HClO4、KOH、Ca(OH)2;
(4)S、Cl对应的气态氢化物分子式为HCl、H2S,同周期自左而右金属性减弱、非金属性增强,氢化物稳定性增强,所以它们的稳定性顺序为HCl>H2S,
故答案为:HCl>H2S;
点评:本题考查结构性质位置关系应用,充分根据核外电子排布推断A、D,注意掌握微粒半径比较规律,难度不大.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
下列四种基本类型的反应中,一定不是氧化还原反应的是( )
| A、化合反应 | B、分解反应 |
| C、置换反应 | D、复分解反应 |
向一定量的Fe、FeO和Fe2O3的混合物中加入120ml 4mol∕L的稀硝酸,恰好使混合物完全溶解,放出2.24LNO(标况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的氢气在加热条件下还原相同质量的混合物,能得到铁的物质的量为( )
| A、0.21mol |
| B、0.24mol |
| C、0.19mol |
| D、0.14mol |
 某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如图装置.倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)
某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如图装置.倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况) 甲、乙探究小组同学对铁及其化合物的性质进行了探究,试回答下列问题:
甲、乙探究小组同学对铁及其化合物的性质进行了探究,试回答下列问题: 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.图2中,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.图2中,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气. 利用如图装置可验证同主族元素非金属性的变化规律
利用如图装置可验证同主族元素非金属性的变化规律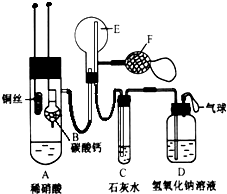 为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的打气球.
为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的打气球.