题目内容
一定温度下,有a、盐酸 b、硫酸 c、醋酸三种酸的稀溶液.(用a、b、c、<、=、>号填写)
(1)当其物质的量浓度相同时,c(H+)由大到小的顺序是 ,
(2)同体积同物质的量浓度的三种酸,中和NaOH能力的顺序是 ,
(3)当其c(H+)相同时,物质的量浓度由大到小的顺序为 ,
(4)当c(H+)相同、体积相同时,分别加入足量锌,相同状况产生的气体体积由大到小的顺序为 .
(5)当pH相同、体积相同时,同时加入 锌,若产生相同体积的氢气(相同状况)则开始时反应速率的顺序为 ,反应所需的时间的顺序为 .
(6)将c(H+)相同的三种酸均稀释10倍,则稀释后c(H+)由大到小的顺序为 .
(1)当其物质的量浓度相同时,c(H+)由大到小的顺序是
(2)同体积同物质的量浓度的三种酸,中和NaOH能力的顺序是
(3)当其c(H+)相同时,物质的量浓度由大到小的顺序为
(4)当c(H+)相同、体积相同时,分别加入足量锌,相同状况产生的气体体积由大到小的顺序为
(5)当pH相同、体积相同时,同时加入
(6)将c(H+)相同的三种酸均稀释10倍,则稀释后c(H+)由大到小的顺序为
考点:弱电解质在水溶液中的电离平衡,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)物质的量浓度相等的酸,硫酸和氯化氢是强电解质,完全电离,醋酸是一元弱酸,部分电离,据此确定氢离子浓度大小;
(2)同体积同物质的量浓度的三种酸,中和NaOH能力与氢的物质的量成之比,氢的物质的量越大,需要的氢氧化钠的物质的量越大;
(3)如果酸是强电解质,一元酸的浓度与氢离子浓度相等,二元酸的浓度为氢离子浓度的一半;如果酸是弱电解质,一元酸的浓度大于氢离子浓度;
(4)当c(H+)相同、体积相同时,醋酸提供氢离子能力最强,而盐酸和醋酸能力相同;
(5)产生相同体积的氢气,则参加反应的锌相等,反应时产生氢(气)的速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大,速度越快所需的时间越短;
(6)强酸溶液稀释10倍,氢离子浓度变为原来的
,弱酸溶液稀释10倍,氢离子浓度变为大于原来的
.
(2)同体积同物质的量浓度的三种酸,中和NaOH能力与氢的物质的量成之比,氢的物质的量越大,需要的氢氧化钠的物质的量越大;
(3)如果酸是强电解质,一元酸的浓度与氢离子浓度相等,二元酸的浓度为氢离子浓度的一半;如果酸是弱电解质,一元酸的浓度大于氢离子浓度;
(4)当c(H+)相同、体积相同时,醋酸提供氢离子能力最强,而盐酸和醋酸能力相同;
(5)产生相同体积的氢气,则参加反应的锌相等,反应时产生氢(气)的速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大,速度越快所需的时间越短;
(6)强酸溶液稀释10倍,氢离子浓度变为原来的
| 1 |
| 10 |
| 1 |
| 10 |
解答:
解:(1)氯化氢和硫酸是强电解质,在水中完全电离,盐酸是一元酸,所以盐酸中c(H+)=c(HCl),硫酸是二元酸,硫酸溶液中c(H+)=2c(H2SO4),醋酸是一元弱酸,所以醋酸溶液中c(H+)<c(CH3COOH),所以等物质的量浓度的三种酸,氢离子浓度大小顺序是b>a>c,故答案为:b>a>c;
(2)同体积同物质的量浓度的三种酸,三种酸n(HCl)=n(CH3COOH)=n(H2SO4),盐酸和醋酸是一元酸,硫酸是二元酸,盐酸和醋酸需要氢氧化钠的物质的量相等,硫酸需要的氢氧化钠是盐酸和醋酸的2倍,中和NaOH能力由大到小的顺序是b>a=c,故答案为:b>a=c;
(3)氯化氢和硫酸是强电解质,盐酸是一元酸,硫酸是二元酸,醋酸是弱电解质且是一元酸,所以盐酸中氢离子浓度与酸的浓度相等,硫酸中氢离子浓度是硫酸的浓度的2倍,醋酸中氢离子浓度小于醋酸的浓度,所以如果氢离子浓度相等时,物质的量浓度由大到小的顺序为c>a>b,故答案为:c>a>b;
(4)当c(H+)相同、体积相同时,醋酸提供氢离子能力最强,而盐酸和醋酸能力相同,所以加入足量锌,相同状况产生的气体体积由大到小的顺序为c>a=b,
故答案为:c>a=b;
(5)产生相同体积的氢气,则参加反应的锌相等,与锌反应时产生氢(气)的速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大,当c(H+)相同、体积相同时,相同的锌,则开始时反应速率的大小关系是a=b=c,整个过程中醋酸在不断的电离出氢离子,所以所需的时间醋酸最短,反应所需的时间的顺序为a=b>c,
故答案为:相同;a=b=c;a=b>c;
(6)强酸溶液稀释10倍,氢离子浓度变为原来的
,弱酸溶液稀释10倍,氢离子浓度变为大于原来的
,盐酸和硫酸是强酸,醋酸是弱酸,所以c(H+)由大到小的顺序为c>a=b,故答案为:c>a=b.
(2)同体积同物质的量浓度的三种酸,三种酸n(HCl)=n(CH3COOH)=n(H2SO4),盐酸和醋酸是一元酸,硫酸是二元酸,盐酸和醋酸需要氢氧化钠的物质的量相等,硫酸需要的氢氧化钠是盐酸和醋酸的2倍,中和NaOH能力由大到小的顺序是b>a=c,故答案为:b>a=c;
(3)氯化氢和硫酸是强电解质,盐酸是一元酸,硫酸是二元酸,醋酸是弱电解质且是一元酸,所以盐酸中氢离子浓度与酸的浓度相等,硫酸中氢离子浓度是硫酸的浓度的2倍,醋酸中氢离子浓度小于醋酸的浓度,所以如果氢离子浓度相等时,物质的量浓度由大到小的顺序为c>a>b,故答案为:c>a>b;
(4)当c(H+)相同、体积相同时,醋酸提供氢离子能力最强,而盐酸和醋酸能力相同,所以加入足量锌,相同状况产生的气体体积由大到小的顺序为c>a=b,
故答案为:c>a=b;
(5)产生相同体积的氢气,则参加反应的锌相等,与锌反应时产生氢(气)的速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大,当c(H+)相同、体积相同时,相同的锌,则开始时反应速率的大小关系是a=b=c,整个过程中醋酸在不断的电离出氢离子,所以所需的时间醋酸最短,反应所需的时间的顺序为a=b>c,
故答案为:相同;a=b=c;a=b>c;
(6)强酸溶液稀释10倍,氢离子浓度变为原来的
| 1 |
| 10 |
| 1 |
| 10 |
点评:本题考查了弱电解质的电离及溶液中离子浓度大小的比较,根据电解质的强弱及酸的元数来分析解答即可,难度较大,注意弱电解质稀释时溶液中各种离子浓度的变化,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 某固体物质和某溶液在一定条件下反应,产生气体的相对分子质量(或平均相对分子质量)为45,则发生反应的物质一定不可能是( )
某固体物质和某溶液在一定条件下反应,产生气体的相对分子质量(或平均相对分子质量)为45,则发生反应的物质一定不可能是( )| A、Zn和浓H2SO4 |
| B、Na2O2和NH4Cl浓溶液 |
| C、Cu和浓HNO3 |
| D、C和浓HNO3 |
标准状况下有①6.72L甲烷 ②3.01×1023个氯化氢分子 ③13.6g硫化氢④0.2mol NH3.下列对这四种气体的关系从小到大表示不正确的是( )
| A、体积:④<①<②<③ |
| B、密度:①<④<③<② |
| C、质量:④<①<③<② |
| D、氢原子数:②<④<③<① |
 某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如图装置.倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)
某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如图装置.倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)


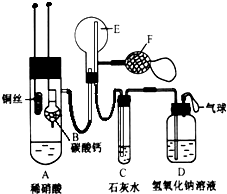 为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的打气球.
为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的打气球.