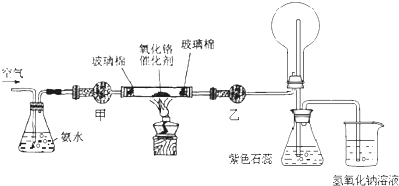
题目内容
实验室常用KClO3晶体和浓盐酸反应制取氯气,反应的化学方程式为KClO3++6HCl(浓)═KCl+3Cl2↑+3H2O.
(1)氧化产物是 ,还原产物是 ;
(2)被氧化与被还原的氯原子的数目比是 .
(1)氧化产物是
(2)被氧化与被还原的氯原子的数目比是
考点:氧化还原反应
专题:氧化还原反应专题
分析:KClO3+6HCl
KCl+3Cl2↑+3H2O中,Cl元素的化合价由+5价降低为0,Cl元素的化合价由-1价升高为0,以此来解答.
| ||
解答:
解:(1)KClO3+6HCl
KCl+3Cl2↑+3H2O中,Cl元素的化合价由-1价升高为0,失去电子被氧化,5molHCl作还原剂,对应氧化产物;
Cl元素的化合价由+5价降低为0,得到电子被还原,对应还原产物,氯气既是氧化产物又是还原产物,
故答案为:Cl2;Cl2;
(2)反应中Cl元素化合价分别由+5价降低到0价、-1价升高到0价,由得失电子守恒可知,Cl原子守恒可知,被氧化与被还原的氯原子的数目比为5:1,
故答案为:5:1.
| ||
Cl元素的化合价由+5价降低为0,得到电子被还原,对应还原产物,氯气既是氧化产物又是还原产物,
故答案为:Cl2;Cl2;
(2)反应中Cl元素化合价分别由+5价降低到0价、-1价升高到0价,由得失电子守恒可知,Cl原子守恒可知,被氧化与被还原的氯原子的数目比为5:1,
故答案为:5:1.
点评:本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,注意Cl原子守恒及氯气既是氧化产物又是还原产物,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列四种基本类型的反应中,一定不是氧化还原反应的是( )
| A、化合反应 | B、分解反应 |
| C、置换反应 | D、复分解反应 |
下图为向25ml0.1mol/LNaOH溶液中逐滴0.2mol/L醋酸溶液,当滴定至B点时,pH=7,溶液呈中性,下列关系式错误的是( )
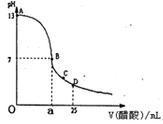

| A、c(H+)=c(OH-) |
| B、c(Na+)=c(CH3COO-) |
| C、a=12.5 |
| D、a>12.5 |
向一定量的Fe、FeO和Fe2O3的混合物中加入120ml 4mol∕L的稀硝酸,恰好使混合物完全溶解,放出2.24LNO(标况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的氢气在加热条件下还原相同质量的混合物,能得到铁的物质的量为( )
| A、0.21mol |
| B、0.24mol |
| C、0.19mol |
| D、0.14mol |
在一个不传热的固定容积的密闭容器中发生可逆反应:mA(g)+nB(g)?pC(g)+qD(g),当m、n、p、q为任意整数(不为零)时,不能说明达到平衡状态的标志是( )
| A、A的百分含量不再改变 |
| B、各组分的浓度不再改变 |
| C、反应速率υA:υB:υC:υD=m:n:p:q |
| D、单位时间内m mol A断键发生反应,同时p mol C也断键发生反应 |
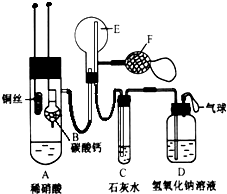 为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的打气球.
为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的打气球.