题目内容
13.设NA为阿伏伽德罗常数的值,则1molCu与足量的S完全反应,转移的电子数为( )| A. | NA | B. | 1.5NA | C. | 2NA | D. | 不能确定 |
分析 铜和硫反应后变为+1价,故1mol铜失去1mol电子,据此分析.
解答 解:铜和硫反应后变为+1价,故1mol铜失去1mol电子,个数N=nNA=1mol×NA/mol=NA个,故选A.
点评 本题考查了铜和硫反应后转移电子数的计算,难度不大,应注意的是铜和硫反应后变为+1价.

练习册系列答案
相关题目
3.能与SO2气体发生反应,但无沉淀产生的是( )
①溴水②Ba(OH)2溶液③氢硫酸④Na2CO3⑤稀H2SO4⑥Na2SO3.
①溴水②Ba(OH)2溶液③氢硫酸④Na2CO3⑤稀H2SO4⑥Na2SO3.
| A. | 只有① | B. | ①③④ | C. | ④⑤⑥ | D. | ①④⑥ |
4.下列说法正确的是( )
| A. | 含有羟基的化合物一定属于醇类 | |
| B. | 苯酚可以使紫色石蕊试液变红 | |
| C. | 分子中含有苯环和羟基的化合物一定是酚 | |
| D. | Na2O2、苯酚久置于空气中,颜色均有变化 |
1.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4L乙烯中含有的共用电子对数为6NA | |
| B. | 1L pH=13的氢氧化钡溶液中含有的OH-离子数为0.2NA | |
| C. | 46g的无水乙醇与足量乙酸在浓硫酸中加热,可生成88g乙酸乙酯 | |
| D. | 在反应KIO3+6HI═KI+3I2+3H2O中,若有1molH2O生成,则转移电子数为2NA |
8.下列装置应用于实验室制NO并回收硝酸铜的实验,能达到实验目的是( )
| A. | 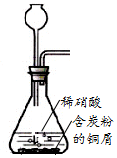 用装置制取NO | |
| B. |  用装置收集NO | |
| C. | 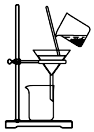 用装置分离炭粉和硝酸铜溶液 | |
| D. | 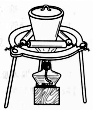 用装置蒸干硝酸铜溶液制Cu(NO3)2•3H2O |
1.下列叙述正确的是( )
| A. | 每摩尔物质约含有6.02×1023个粒子 | |
| B. | 摩尔是七个基本物理量之一 | |
| C. | 摩尔是物质的质量单位 | |
| D. | 摩尔是物质的数量单位 |
8.下列说法正确的是( )
| A. | 水蒸气通过炽热的铁,生成Fe2O3和H2 | |
| B. | 用湿润的淀粉碘化钾试纸检验某气体,试纸变蓝,该气体一定是Cl2 | |
| C. | 除去NO中混有的少量NO2,可将混合气体通过盛有水的洗气瓶,再用排空气法收集NO | |
| D. | 反应MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O中,每析出12.8 g S共转移0.8mol |
5.在KCl、MgCl2、MgSO4形成的混合溶液中,c(K+)=0.1mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.2mol/L,则c(SO42-)为( )
| A. | 0.15mol/L | B. | 0.20mol/L | C. | 0.25mol/L | D. | 0.40mol/L |
6.下列指定反应的离子方程式正确的是( )
| A. | FeO溶于稀硝酸:FeO+2H+═Fe2++H2O | |
| B. | Al2(SO4)3溶液中加入过量Ba(OH)2溶液:Al3++4OH-═AlO2-+2H2O | |
| C. | 漂白粉溶液中通入少量CO2:2ClO-+H2O+CO2═2HClO+CO32- | |
| D. | 等物质的量的NO和NO2同时被NaOH溶液吸收:NO+NO2+2OH-═2NO2-+H2O |