题目内容
11.下列反应中前者属于取代反应,后者属于加成反应的是( )| A. | 甲烷与氯气混和后光照反应;乙烯使酸性高锰酸钾溶液的褪色 | |
| B. | 乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷 | |
| C. | 苯与浓硝酸和浓硫酸的混合液反应生成油状液体;乙烯与水生成乙醇的反应 | |
| D. | 乙烯与溴水反应;乙酸与乙醇的酯化反应 |
分析 A.甲烷与氯气混和后光照反应,为取代反应;乙烯使酸性高锰酸钾溶液的褪色,为氧化反应;
B.乙烯与溴的四氯化碳溶液反应,为加成反应;苯与氢气在一定条件下反应生成环己烷,为加成反应;
C.苯与浓硝酸和浓硫酸的混合液反应生成油状液体,苯中H被取代;乙烯与水生成乙醇的反应,碳碳双键转化为-OH;
D.乙烯与溴水反应,为加成反应;乙酸与乙醇的酯化反应,为取代反应.
解答 解:A.分别为取代反应、氧化反应,故A不选;
B.均为加成反应,故B不选;
C.分别为取代反应、加成反应,故C选;
D.分别为加成反应、取代反应,故D不选;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的性质、有机反应类型判断等为解答的关键,侧重分析与应用能力的考查,注意有机反应中官能团的变化,题目难度不大.

练习册系列答案
相关题目
10.反应4NH3+5O2=4NO+6H2O 在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为( )
| A. | v(O2)=0.0025 mol/(L•s) | B. | v(NO)=0.008 mol/(L•s) | ||
| C. | v(H2O)=0.003 mol/(L•s) | D. | v(NH3)=0.002 mol/(L•s) |
2.已知115号元素的一种核素为289X,下列有关叙述正确的是( )
| A. | 115号元素可显+5价 | B. | X原子的中子数与电子数之差为174 | ||
| C. | 115号元素位于周期表第八周期 | D. | 115号元素属于非金属元素 |
19.将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO).向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g.下列叙述不正确的是( )
| A. | 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100 mL | |
| B. | 当金属全部溶解时收集到NO气体的体积一定为2.24 L | |
| C. | 参加反应的金属的总质量3.6 g<m<9.6 g | |
| D. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4 mol |
6.下列哪些性质不能区别晶体与玻璃体( )
| A. | 各向异性 | B. | X-射线衍射 | ||
| C. | 导电性 | D. | 有规则的几何外形 |
16. 已知:①抗坏血酸(C6H8O6)(Vc)溶于水和乙醇,具有抗氧化性,可使酸性高锰酸钾溶液褪色;
已知:①抗坏血酸(C6H8O6)(Vc)溶于水和乙醇,具有抗氧化性,可使酸性高锰酸钾溶液褪色;
②磷酸亚铁[Fe3(PO4)2•8H2O]为白蓝色单斜晶体,溶于稀酸,不溶于水、乙醇、醋酸.
I.磷酸亚铁是生产LiFePO4电池的原料,实验室利用FeSO4•7H2O、Na2HPO4•12H2O及CH3COONa•3H2O为原料制备磷酸亚铁晶体,合成时的主要反应为:
3FeSO4+2Na2HPO4+2CH3COONa+8H2O=Fe3(PO4)2•8H2O↓+3Na2SO4+2CH3COOH
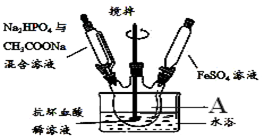
装置如图所示:
实验步骤:
①在50mL干净的仪器A中加入抗坏血酸(C6H8O6)稀溶液作底液;
②滴入足量Na2HPO4与CH3COONa混合溶液至pH=4;
③滴入含15.2g克FeSO4的溶液,最终维持pH=6,充分反应后静置;
④进行过滤和操作b,低温烘干得到磷酸亚铁晶体12.8克.
请回答下列问题:
(1)仪器A的名称是三颈烧瓶;
(2)配制FeSO4溶液时所用的蒸馏水应先进行的操作是煮沸除去水中的溶解的氧气.
(3)步骤④操作b的名称是洗涤,检验操作b是否完全的方法是取最后一次洗涤滤出液1-2mL于试管,滴入BaCl2溶液,若无白色沉淀,说明洗涤干净.
(4)抗坏血酸溶液的作用是防止磷酸亚铁被氧化.
(5)本实验的产率是76.5%(M[Fe3(PO4)2•8H2O]=502g•mol-1).
Ⅱ.水果和蔬菜中含有丰富的Vc,某研究性学习小组对它探究如下:
探究一:测定果汁中Vc的含量
分别向盛有lmL等浓度高锰酸钾稀溶液的四只试管中逐滴滴加梨汁、橙汁、苹果汁和0.04%的Vc溶液,边滴边振荡,直至高锰酸钾溶液褪色,测得以下数据:
(6)分析数据可知,三种果汁中Vc含量最高的是橙汁,其含量为0.02%;(各液体密度上的差别和每一滴的体积差别忽略不计).
探究二:蔬菜放置时间的长短对其Vc含量是否有影响
(7)请你用新鲜的西红柿、放置一周的西红柿、高锰酸钾稀溶液和必要的仪器设计实验方案:将新鲜西红柿和放置一周的西红柿分别捣碎,用纱布将汁液分别挤入两个烧杯中,向取有等量高锰酸钾稀溶液的两支试管中,分别滴入上述两种西红柿汁,边滴边振荡,直到高锰酸钾溶液刚好褪色,记录滴数..
 已知:①抗坏血酸(C6H8O6)(Vc)溶于水和乙醇,具有抗氧化性,可使酸性高锰酸钾溶液褪色;
已知:①抗坏血酸(C6H8O6)(Vc)溶于水和乙醇,具有抗氧化性,可使酸性高锰酸钾溶液褪色;②磷酸亚铁[Fe3(PO4)2•8H2O]为白蓝色单斜晶体,溶于稀酸,不溶于水、乙醇、醋酸.
I.磷酸亚铁是生产LiFePO4电池的原料,实验室利用FeSO4•7H2O、Na2HPO4•12H2O及CH3COONa•3H2O为原料制备磷酸亚铁晶体,合成时的主要反应为:
3FeSO4+2Na2HPO4+2CH3COONa+8H2O=Fe3(PO4)2•8H2O↓+3Na2SO4+2CH3COOH
装置如图所示:
实验步骤:
①在50mL干净的仪器A中加入抗坏血酸(C6H8O6)稀溶液作底液;
②滴入足量Na2HPO4与CH3COONa混合溶液至pH=4;
③滴入含15.2g克FeSO4的溶液,最终维持pH=6,充分反应后静置;
④进行过滤和操作b,低温烘干得到磷酸亚铁晶体12.8克.
请回答下列问题:
(1)仪器A的名称是三颈烧瓶;
(2)配制FeSO4溶液时所用的蒸馏水应先进行的操作是煮沸除去水中的溶解的氧气.
(3)步骤④操作b的名称是洗涤,检验操作b是否完全的方法是取最后一次洗涤滤出液1-2mL于试管,滴入BaCl2溶液,若无白色沉淀,说明洗涤干净.
(4)抗坏血酸溶液的作用是防止磷酸亚铁被氧化.
(5)本实验的产率是76.5%(M[Fe3(PO4)2•8H2O]=502g•mol-1).
Ⅱ.水果和蔬菜中含有丰富的Vc,某研究性学习小组对它探究如下:
探究一:测定果汁中Vc的含量
分别向盛有lmL等浓度高锰酸钾稀溶液的四只试管中逐滴滴加梨汁、橙汁、苹果汁和0.04%的Vc溶液,边滴边振荡,直至高锰酸钾溶液褪色,测得以下数据:
| 梨汁 | 苹果汁 | 橙汁 | 0.04%的Vc溶液 | |
| 滴加的滴数 | 40 | 20 | 10 | 5 |
探究二:蔬菜放置时间的长短对其Vc含量是否有影响
(7)请你用新鲜的西红柿、放置一周的西红柿、高锰酸钾稀溶液和必要的仪器设计实验方案:将新鲜西红柿和放置一周的西红柿分别捣碎,用纱布将汁液分别挤入两个烧杯中,向取有等量高锰酸钾稀溶液的两支试管中,分别滴入上述两种西红柿汁,边滴边振荡,直到高锰酸钾溶液刚好褪色,记录滴数..
1.在标准状态下,气体甲和气体乙的密度分别为1.250克/升、1.875克/升,甲、乙的混合气体对氢气的相对密度为16.8,则混合气体中甲和乙的体积比为( )
| A. | 1:1 | B. | 2:1 | C. | 2:3 | D. | 3:2 |
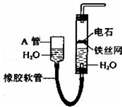 如图所示实验装置可用于制取乙炔.
如图所示实验装置可用于制取乙炔.