题目内容
下列电子式书写正确的是( )
A、 |
B、 |
C、 |
D、 |
考点:电子式
专题:化学键与晶体结构
分析:A.氮气为共价化合物,氮气分子中存在氮氮三键,电子式中三对共用电子对的表示方法错误;
B.二氧化碳分子中存在两个碳氧双键,不是碳氧单键;
C.氢氧根离子中存在一个氧氢键,氧原子最外层为8个电子;
D.次氯酸中存在1个氧氢键和一个氧氯键,不存在氢氯键.
B.二氧化碳分子中存在两个碳氧双键,不是碳氧单键;
C.氢氧根离子中存在一个氧氢键,氧原子最外层为8个电子;
D.次氯酸中存在1个氧氢键和一个氧氯键,不存在氢氯键.
解答:
解:A.氮气中存在氮氮三键,氮氮三键的表示方法错误,氮气正确的电子式为: ,故A错误;
,故A错误;
B.二氧化碳为共价化合物,分子中存在的是碳氧双键,二氧化碳的电子式为: ,故B错误;
,故B错误;
C.氢氧根离子为复杂阴离子,其电子式中需要标出最外层电子数及所带的电荷,氢氧根离子的电子式为: ,故C正确;
,故C正确;
D.次氯酸中不存在氢氯键,次氯酸中存在1个氧氯键和1个氢氧键,次氯酸的电子式为: ,故D错误;
,故D错误;
故选C.
 ,故A错误;
,故A错误;B.二氧化碳为共价化合物,分子中存在的是碳氧双键,二氧化碳的电子式为:
 ,故B错误;
,故B错误;C.氢氧根离子为复杂阴离子,其电子式中需要标出最外层电子数及所带的电荷,氢氧根离子的电子式为:
 ,故C正确;
,故C正确;D.次氯酸中不存在氢氯键,次氯酸中存在1个氧氯键和1个氢氧键,次氯酸的电子式为:
 ,故D错误;
,故D错误;故选C.
点评:本题考查了电子式的书写判断,题目难度中等,注意掌握电子式的概念及正确书写方法,明确离子化合物、共价化合物的电子式的区别.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
已知M、W、X、Y、Z为短周期元素,M为形成化合物最多的元素,W、Z同主族,X、Y、Z同周期,Z元素的原子序数为W的2倍,Z的最外层电子数为Y的最外层电子数的2倍,W和X能形成X2W和X2W2两种化合物,下列说法不正确的是( )
| A、W、X、Y形成的简单离子,其半径大小关系为Y>W>X |
| B、M、W元素形成的简单氢化物的稳定性:W>M |
| C、X金属元素是同周期中金属性最强的元素 |
| D、Z的最高价氧化物对应的水化物的浓溶液能与Y在常温下剧烈反应 |
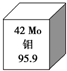 我国安徽发现了全国最大的钼矿,如图是钼元素的相关信息,下列有关钼的说法错误的是( )
我国安徽发现了全国最大的钼矿,如图是钼元素的相关信息,下列有关钼的说法错误的是( )| A、95Mo原子核内有53个中子 |
| B、95Mo原子核外有42个电子 |
| C、92Mo、95Mo、98Mo互为同位素 |
| D、92Mo、95Mo、98Mo的化学性质有较大的不同 |
下列实验过程和过程中涉及的离子反应方程式肯定正确的是( )
| A、除去硫酸铜溶液中的硫酸亚铁以最终制备胆矾晶体:2Fe2++Cl2=2Fe3++2Cl- |
| B、在含有Mn2+的溶液中加入HNO3酸化,再加入PbO2,反应体系显紫红色,5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O |
| C、向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-=BaSO4+NH3?H2O+H2O |
| D、氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O |
下列电离方程式书写正确的是( )
A、Al2(SO4)3═Al
| ||
| B、NaOH═Na++O2-+H+ | ||
C、NaHCO3═Na++H++CO
| ||
D、Na3PO4═3Na++PO
|
设阿伏伽德罗常数为NA,下列说法正确的是( )
| A、1.8g重水(D2O)中含NA个中子 |
| B、NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
| C、标准状况下,含有NA个分子的氧气和氮气的混和气体的体积约为22.4L |
| D、制取漂白粉的反应中,每消耗7.1g Cl2,则转移0.2NA个电子 |
核电荷数为1~20的元素中,次外层电子数是最外电子层电子数4倍的元素共有( )
| A、4种 | B、3种 | C、2种 | D、1种 |
 Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.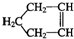 可简写为
可简写为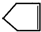 .降冰片烯的分子结构可表示为:
.降冰片烯的分子结构可表示为: