题目内容
16.有如下三个热化学方程式:2H2(g)+O2(g)═2H2O(g)△H=a kJ•mol-12H2(g)+O2(g)═2H2O(l)△H=b kJ•mol-1
4H2(g)+2O2(g)═4H2O(l)△H=c kJ•mol-1
关于它们的下列表述正确的是( )
| A. | 它们都是吸热反应 | B. | a、b和c均为正值 | ||
| C. | a=b | D. | 2b=c |
分析 燃烧反应为放热反应,焓变为负,且物质的量与热量成正比,气态比液态能量高,以此来解答.
解答 解:A.均为放热反应,故A错误;
B.焓变为负,a、b和c均为负值,故B错误;
C.2H2(g)+O2(g)═2H2O(g)△H=a kJ•mol-1、2H2(g)+O2(g)═2H2O(l)△H=b kJ•mol-1,水的状态不同,则a≠b,故C错误;
D.由物质的量与热量成正比可知,2b=c,故D正确;
故选D.
点评 本题考查反应热与焓变,为高频考点,把握反应中热量变化、物质的量与热量的关系为解答的关键,侧重分析与应用能力的考查,注意物质状态与能量的关系,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列说法正确的是( )
| A. | 1 mol H2SO4与 1 mol Ba(OH)2完全反应放出的热量叫做中和热 | |
| B. | 用弱酸的稀溶液做中和热测定实验,测得中和反应反应热偏大 | |
| C. | 一定量H2燃烧生成气态水时比生成液态水时放出的热量多 | |
| D. | 在101 kPa时,1 molH2在Cl2中燃烧时放出的热量也是H2的燃烧热 |
7.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 能使酚酞试液变红的溶液中:H+、SO42-、Na+、NO3- | |
| B. | 加入Al能放出氢气的溶液中:NH4+、SO42-、Mg2+、HCO3- | |
| C. | 含有大量Cl2的溶液中:Ba2+、K+、NO3-、I- | |
| D. | 强酸性的溶液中:Cu2+、Br-、Ca2+、Cl- |
4.下列反应中,属于氧化还原反应的是( )
| A. | CaO+H2O═Ca(OH)2 | B. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$2H2O+CO2 | ||
| C. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | Na2SiO3+2HCl═2NaCl+H2SiO3(胶体) |
1. 有一化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图所示是A的转化率同压强、温度的关系,分析图3可以得出的正确结论是( )
有一化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图所示是A的转化率同压强、温度的关系,分析图3可以得出的正确结论是( )
 有一化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图所示是A的转化率同压强、温度的关系,分析图3可以得出的正确结论是( )
有一化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图所示是A的转化率同压强、温度的关系,分析图3可以得出的正确结论是( )| A. | 正反应吸热,m+n>p+q | B. | 正反应吸热,m+n<p+q | ||
| C. | 正反应放热,m+n>p+q | D. | 正反应放热,m+n<p+q |
8.下列各组中的物质均能发生加成反应的是( )
| A. | 乙烯和乙醇 | B. | 苯和氯乙烯 | C. | 乙酸和溴乙烷 | D. | 丙烯和聚丙烯 |
5.下列叙述正确的是( )
| A. | 0.1mol•L-1氨水中,c(OH-)=c(NH4+) | |
| B. | 在0.1mol•L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) | |
| C. | 10 mL 0.02mol•L-1HCl溶液与10 mL 0.02mol•L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=10 | |
| D. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A) |
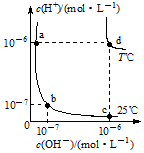 不同温度下,水溶液中c(H+)与c(OH-)的关系如图所示.回答下列问题:
不同温度下,水溶液中c(H+)与c(OH-)的关系如图所示.回答下列问题: