题目内容
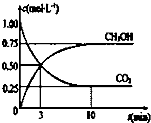 目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kj?mol-1,现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3PH(g)的浓度随时间的变化如图所示.
目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kj?mol-1,现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3PH(g)的浓度随时间的变化如图所示.①从反应开始到平衡,氢气的平均反应速率v(H2)=
②反应达到平衡后,下列措施能使
| c(CH3OH) |
| c(CO2) |
A.升高温度 B.再充入H2 C.再充入CO2 D.将H2O(g)从体系中分离 E.充入He(g)
考点:化学平衡的影响因素,反应速率的定量表示方法
专题:
分析:①根据CO2和CH3OH(g)的浓度随时间的变化的图示,先根据甲醇的浓度变化计算出消耗的氢气的浓度,再计算出氢气的平均反应速率;
②使
增大,反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)向着正向移动,据此根据平衡移动原理进行分析.
②使
| c(CH3OH) |
| c(CO2) |
解答:
解:①根据图示可知,10min达到平衡状态,甲醇浓度为0.75mol/L,由反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)可知,消耗氢气的浓度为:0.75mol/L×3=2.25mol/L,氢气平均反应速率为:
=0.225mol/(L?min),
故答案为:0.225mol/(L?min);
②
增大,反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)向着正向移动,
A.升高温度,该反应放热,升高温度,平衡向着逆向移动,
减小,故A错误;
B.再充入H2,平衡向着正向移动,
增大,故B正确;
C.再充入CO2,平衡向着正向移动,但是二氧化碳浓度增加的大于甲醇增大浓度,
减小,故C错误;
D.将H2O(g)从体系中分离,平衡向着正向移动,
增大,故D正确;
E.充入He(g),各组分浓度不变,平衡不移动,
不变,故E错误;
故答案为:BD.
| 2.25mol/L |
| 10min |
故答案为:0.225mol/(L?min);
②
| c(CH3OH) |
| c(CO2) |
A.升高温度,该反应放热,升高温度,平衡向着逆向移动,
| c(CH3OH) |
| c(CO2) |
B.再充入H2,平衡向着正向移动,
| c(CH3OH) |
| c(CO2) |
C.再充入CO2,平衡向着正向移动,但是二氧化碳浓度增加的大于甲醇增大浓度,
| c(CH3OH) |
| c(CO2) |
D.将H2O(g)从体系中分离,平衡向着正向移动,
| c(CH3OH) |
| c(CO2) |
E.充入He(g),各组分浓度不变,平衡不移动,
| c(CH3OH) |
| c(CO2) |
故答案为:BD.
点评:本题考查了化学反应速率的求算、反应进行的方向的判断,题目难度中等.

练习册系列答案
相关题目
下列各组物质中,肯定是同系物的是( )
A、 和 和 |
B、CH2=CH2和 |
| C、C2H2和C4H4 |
| D、正戊烷和2-甲基丁烷 |
纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体.下列区分这种两种物质的方法正确的是( )
| A、用洁净铁丝蘸取两种样品在煤气火焰上灼烧,使火焰颜色发生明显变化的是小苏打 |
| B、用两只玻璃杯分别加入少量的两种样品,再加入等量的食醋,产生气泡快的是小苏打 |
| C、分别用炒锅加热两种样品,全部分解挥发,没有残留物质的是小苏打 |
| D、先将两样品配成溶液,分别加入石灰水,无白色沉淀生成的是小苏打 |
下列过程或现象与盐类水解无关的是( )
| A、热的纯碱溶液用于去油污 |
| B、加热氯化铁溶液颜色变深 |
| C、饱和食盐水使甲基橙显黄色 |
| D、泡沫灭火器中的Al2(SO4)3溶液不能装在铁筒里 |
2SO2(g)+O2(g)?2SO3(g)是制备硫酸的重要反应.下列叙述正确的是( )
| A、催化剂V2O3不改变该反应的逆反应速率 | ||
| B、增大反应体系的压强,反应速率一定增大 | ||
| C、该反应是放热反应,降低温度将缩短反应达到平衡的时间 | ||
D、在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=
|
在密闭容器中,一定条件下,进行如下反应:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.4kJ/mol,达到平衡后,下列条件都能同时提高反应速率和NO 的转化率的是( )
| A、加催化剂同时升高温度 |
| B、降低温度同时增大压强 |
| C、增大压强同时充入CO |
| D、加催化剂同时增大压强 |
气态中性基态原子的原子核外电子排布发生如下变化,吸收能量最多的是( )
| A、1s22s22p63s23p2→1s22s22p63s23p1 |
| B、1s22s22p63s23p3→1s22s22p63s23p2 |
| C、1s22s22p63s23p4→1s22s22p63s23p3 |
| D、1s22s22p63s23p1→1s22s22p63s2 |
已知:①2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol②H2(g)+S(g)=H2S(g)△H=-20.1kJ/mol
下列判断一定正确的是( )
下列判断一定正确的是( )
| A、由①知:氢气的燃烧热△H=-241.8 kJ/mol |
| B、由①、②知:2H2S(g)+O2(g)=2S(g)+2H2O(g)△H=-443.4 kJ/mol |
C、 反应②中的能量变化能用图表示 |
| D、若反应②中改用固态硫,放热将大于20.1kJ |
有28gCuO和MgO固体混合物与200ml硫酸恰好完全反应,将反应后的溶液小心蒸干,得到固体68g.则原硫酸溶液的物质的量浓度和原固体混合物中氧元素的质量分数分别是( )
| A、2.5mol?L-1 28.57% |
| B、2.2mol?L-1 23.07% |
| C、1.5mol?L-1 24.55% |
| D、2.5mol?L-1 18.37% |