题目内容
在密闭容器中,一定条件下,进行如下反应:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.4kJ/mol,达到平衡后,下列条件都能同时提高反应速率和NO 的转化率的是( )
| A、加催化剂同时升高温度 |
| B、降低温度同时增大压强 |
| C、增大压强同时充入CO |
| D、加催化剂同时增大压强 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:达到平衡后,为提高该反应的速率和NO的转化率,则加快反应速率使平衡正向移动,以此来解答.
解答:
解:A.催化剂不改变平衡状态,升高温度平衡逆向移动,NO的转化率减小,故A错误;
B.降低温度同时增大压强,能确定反应正向进行,但反应速率不一定增大,故B错误;
C.增大压强,提高反应速率,同时充入CO,平衡正向移动,NO的转化率减小,故C错误;
D.催化剂不改变平衡状态,增大压强,平衡正向移动,NO的转化率增大,且反应速率加快,故D正确.
故选B.
B.降低温度同时增大压强,能确定反应正向进行,但反应速率不一定增大,故B错误;
C.增大压强,提高反应速率,同时充入CO,平衡正向移动,NO的转化率减小,故C错误;
D.催化剂不改变平衡状态,增大压强,平衡正向移动,NO的转化率增大,且反应速率加快,故D正确.
故选B.
点评:本题考查影响化学反应速率的因素,注意把握浓度、催化剂、温度、压强对反应速率的影响和平衡移动即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
对室温下100mL pH=2的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )


| A、加水稀释至溶液体积为200mL,醋酸溶液的pH变为4 |
| B、温度都升高20°C后,两溶液的pH不再相等 |
| C、加水稀释至溶液体积为200mL后,两种溶液中c(OH-)都减小 |
| D、加足量的锌充分反应后,两溶液中产生的氢气体积可用上图表示 |
已知25℃下,0.1mol/L某二元酸(H2A)溶液的pH大于1,其酸式盐NaHA溶液的pH<7.取等体积的H2A溶液和NaOH溶液混合后,所得溶液的pH=7,则酸溶液与碱溶液的物质的量浓度之比是( )
| A、小于0.5 |
| B、等于0.5 |
| C、大于1且小于2 |
| D、大于0.5且小于1 |
下列各组比较,不正确的是( )
| A、氧化性S<O2<F2 |
| B、半径Be2+<Mg2+<K+ |
| C、酸性H2SiO3<H3PO4<H2SO4 |
| D、还原性Se2-<S2-<O2- |
下列离子方程式书写正确的是( )
| A、铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| C、三氯化铁溶液中加入铁粉:Fe3++Fe═2Fe2+ |
| D、向NaOH溶液中滴入少量AlCl3溶液:Al3++4OH-═AlO2-+2H2O |
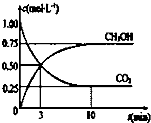 目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kj?mol-1,现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3PH(g)的浓度随时间的变化如图所示.
目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kj?mol-1,现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3PH(g)的浓度随时间的变化如图所示.